题目内容
3. 在实验学习过程时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
在实验学习过程时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.探究一 M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是Ca(OH)2 ②是CaCl2.
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加少量硫酸铜(氯化铜)溶液; | 溶液中出现蓝色沉淀 | 猜想①正确. 反应方程式为: |
(1)【提出猜想】猜想一:NaOH和Na2CO3;猜想二:NaOH和Ca(OH)2;猜想三:NaOH.
(2)【实验探究】设计实验方案确定滤液中溶质的组成.
| 实验操作 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,而后先滴加少量无色酚酞试液,再加入过量氯化钙(或过量氯化钡溶液)溶液. | “猜想一”成立 |
分析 探究一 (1)根据碳酸钠的性质和部分标签的内容进行猜想;根据氢氧化钙或氯化钙溶液的性质分析设计实验;
探究二【提出猜想】根据碳酸钠与氢氧化钙的反应及反应的程度分析猜想;根据氢氧化钠、碳酸钠能与盐酸反应分析实验的结论;根据碳酸钠与氯化钙的反应、氢氧化钙与碳酸钠的反应现象完成实验.
解答 解:探究一 (1)由标签可知,溶液为钙的化合物溶液,能与碳酸钠的反应可能是氢氧化钙或氯化钙;故填:Ca(OH)2;
(2)取少量M溶液于试管中,向其中滴加某溶液,溶液中出现蓝色沉淀,可知沉淀是氢氧化铜沉淀,因此滴加的是氯化铜或硫酸铜溶液等铜的盐溶液;故设计实验如下;
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加硫酸铜溶液(氯化铜溶液) | 溶液变红 | 猜想①正确 |
【实验探究】由于碳酸钠与氯化钙的反应生成沉淀,氢氧化钠溶液显碱性;故填:过量氯化钙溶液(或过量氯化钡溶液); 有白色沉淀出现且溶液红色不消失.
点评 本考点探究了物质的组成成分,解答本题关键是在分析过滤后溶液中溶质成分时不仅要看生成物中溶质,还要看反应物是否有剩余,检验钙离子可以用碳酸根离子来考虑,检验碳酸根离子,可以用钙离子检验.本考点主要出现在实验题中.

练习册系列答案
相关题目
14.据《文汇报》报道,香港大学医学院及玛丽医院成功研发“口服砒霜”,近10年来,已有逾100位血癌病人服用药后康复出院,该药很快将会推广至全球,砒霜的学名为三氧化二砷,化学式为As2O3,能与生石灰发生反应,它属于一种( )
| A. | 金属氧化物 | B. | 有机物 | C. | 非金属氧化物 | D. | 盐 |
11. 探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.实验中采用右图实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.实验中采用右图实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
请回答下列问题:
(1)实验中收集一定体积的氧气采用的实验方法利用了氧气不易溶于水的性质.收集气体前集气瓶内未装满水,对实验结果没有 (填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气时,二氧化锰与氯酸钾的最佳质量比为1:3.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好.请写出前者的两个优点①操作简便②节能.
(4)反思:催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的分析:
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因:二氧化锰用量多,导致反应物氯酸钾的质量分数变小.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是:二氧化锰用量少,导致氯酸钾与二氧化锰的接触面积变小.
 探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.实验中采用右图实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.实验中采用右图实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰的质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
| 二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
| 生成200mL氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
(1)实验中收集一定体积的氧气采用的实验方法利用了氧气不易溶于水的性质.收集气体前集气瓶内未装满水,对实验结果没有 (填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气时,二氧化锰与氯酸钾的最佳质量比为1:3.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好.请写出前者的两个优点①操作简便②节能.
(4)反思:催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的分析:
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因:二氧化锰用量多,导致反应物氯酸钾的质量分数变小.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是:二氧化锰用量少,导致氯酸钾与二氧化锰的接触面积变小.
8. A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是 ( )
A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是 ( )
 A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是 ( )
A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是 ( )| A. | 反应②中所得溶液呈浅绿色 | |
| B. | 反应③中D物质可发生还原反应得到铁 | |
| C. | C物质是盐酸 | |
| D. | 反应①的化学方程式可以是:CO2+Ca(OH)2═CaCO3↓+H2O |
15. 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(1)实验准备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
表中的现象Ⅰ为有气泡产生,现象Ⅱ对应反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(2)实验过程
【实验1】证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图所示实验:先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀;为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明反应后NaHCO3不存在同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生.
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.(1)实验准备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
(2)实验过程
【实验1】证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图所示实验:先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀;为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明反应后NaHCO3不存在同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生.
12. 两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )
两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )
 两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )
两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )| A. | 矿泉水属于溶液 | |
| B. | 水是人体六大类营养物质之一 | |
| C. | 矿泉水中的矿物质钙、锌、铁、硒都属于人体需要的微量元素 | |
| D. | 灌装矿泉水的塑料瓶子由聚乙烯材料制作而成 |
13. 如图是两种元素在周期表中的信息.下列说法正确的是( )
如图是两种元素在周期表中的信息.下列说法正确的是( )
 如图是两种元素在周期表中的信息.下列说法正确的是( )
如图是两种元素在周期表中的信息.下列说法正确的是( )| A. | 氧的相对原子质量是16.00g | B. | 铝原子的质子数是13 | ||
| C. | 氧化铝的化学式AlO | D. | 两种元素都是金属元素 |
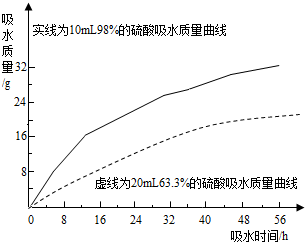 硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题: