题目内容
9.如图是同学们学习过的三个重要实验,仔细观察,回答下列问题: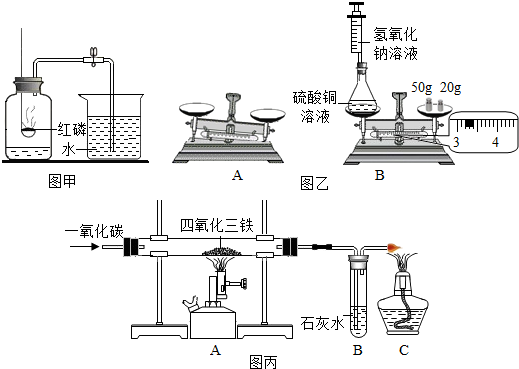
(1)图甲是测定空气中氧气含量的实验,在实验过程中,可观察到:红磷剧烈燃烧、放出大量热、产生大量白烟;打开弹簧夹,集气瓶内水面上升约,燃烧熄灭后,红磷有剩余,则集气瓶内没有(填“仍有”或“没有”)残余的氧气(不考虑气密性不好等因素).
(2)如图乙A所示,天平没有调节平衡,要使该天平平衡,应采取的措施是先将游码归零,再调节平衡螺母;小亮同学用图乙B所示装置进行实验,反应前称得左盘内装置及物质的总重量为73.2g,然后注入氢氧化钠溶液,观察到的现象是产生蓝色沉淀,该反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;反应完毕后,能证明化学反应前后质量守恒的现象是天平仍保持平衡(或称量结果仍为73.2g).
(3)图丙是在实验室里制得铁的装置,回答下列问题:
①A处玻璃管内发生的化学方程式Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.
②B处可观察到的现象是澄清的石灰水变浑浊;C处酒精灯的作用是点燃多余的一氧化碳,避免污染空气.
③待四氧化三铁完全反应后,停止加热A处,在断开A、B之前应继续通入一氧化碳至A处玻璃管冷却,若不继续通入一氧化碳,可能出现的后果是石灰水回流至A处玻璃管中,导致玻璃管炸裂;反应生成的铁被氧化.
分析 (1)红磷燃烧的现象是冒出大量的白烟,放出热量;根据过量红磷为的是把氧气耗尽分析;
(2)在使用天平时要注意把天平平放在桌面上,然后把游码归零,在调节螺母使天平平衡.读数时要把砝码质量加上游码的刻度值,如果天平依然平衡则能够证明质量守恒定律,可以据此作答;
(3)四氧化三铁在高温的条件下被一氧化碳还原为铁,同时生成二氧化碳;
二氧化碳能与澄清的石灰水反应生成碳酸钙白色沉淀和水,尾气中含有有毒的一氧化碳气体,一氧化碳有毒;
根据装置的特点进行分析.
解答 解:(1)红磷燃烧的现象是:剧烈燃烧发黄光、放热、冒出大量的白烟;打开弹簧夹,集气瓶内水面上升约占集气瓶容积的$\frac{1}{5}$.燃烧熄灭后,红磷有剩余,则集气瓶内没有残余的氧气.
故填:产生大量白烟;占集气瓶容积的$\frac{1}{5}$;没有;
(2)根据图中可以看出,游码没有归零,所以难以调节至平衡,为了调节至平衡应该先将游码归零;从图乙可以看出砝码的质量为70g游码的刻度为3.2g,故总质量为73.2g,氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀,天平依然平衡则能够证明质量守恒定律,然后写出该反应的化学方程式.故填:先将游码归零,再调节平衡螺母;73.2;产生蓝色沉淀;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;天平仍保持平衡(或称量结果仍为73.2g);
(3)①四氧化三铁与一氧化碳在高温条件下生成铁和二氧化碳,故答案为:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
②二氧化碳能使澄清的石灰水变浑浊,一氧化碳有毒,因此实验过程中未参与反应的一氧化碳要及时处理,防止污染空气,可利用一氧化碳的可燃性进行处理;故答案为:澄清的石灰水变浑浊;点燃多余的一氧化碳,避免污染空气;
③停止加热A处,玻璃管温度降低,若不继续通一氧化碳,B处石灰水会回流至A处玻璃管,导致玻璃管炸裂且反应生成的铁被氧化.故答案为:石灰水回流至A处玻璃管中,导致玻璃管炸裂;反应生成的铁被氧化.
点评 解答本题关键是要知道根据生成物分析实验现象的方法,熟悉方程式的书写方法,知道一氧化碳还原氧化铁的注意事项,尾气的处理方法.

请回答下列问题:
(1)生石灰加入沸水中,水能持续保持沸腾,其原因是氧化钙和水反应放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl
②可能还含有其它溶质;
甲同学推断只有Ca(OH)2
乙同学推断只有Na2CO3
丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(用化学方程式表示).
【实验探究】
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
| A. | 该反应是置换反应 | B. | 金属R的活动性比Cu强 | ||
| C. | 金属R可能是铝 | D. | 该反应前后R的化合价发生了改变 |
| A. |  分离KNO3和NaCl | B. |  H2还原CuO | ||
| C. |  测定空气中O2的含量 | D. |  收集CO2气体 |
 某研究性学习小组的同学前往当地的大理石进行调査,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测.采用了以下的办法:取16g这种大理石,逐滴滴加稀盐酸,剩余固体的质量与所加盐酸的质量关系如图示(杂质不溶于水,不与盐酸反应).
某研究性学习小组的同学前往当地的大理石进行调査,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测.采用了以下的办法:取16g这种大理石,逐滴滴加稀盐酸,剩余固体的质量与所加盐酸的质量关系如图示(杂质不溶于水,不与盐酸反应).

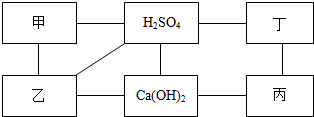 如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.
如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.