题目内容
7.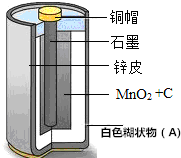 小意对自己使用的一节废旧干电池进行了系列探究;
小意对自己使用的一节废旧干电池进行了系列探究;老师提供以下信息:
①干电池的主要成分见图,A还含有一种盐,且该盐中阴离子是SO42-,CO32-,Cl中的一种;
②碘溶液能使淀粉变蓝.
③NH4Cl,NaCl固体溶于水分别会解离出NH4′与Cl′,Na′与Cl′.小意首先剥开电池锌壳时,闻到一股刺激性气味.
【猜想】该盐可能是铵盐.
【实验1】取A,滴入少量碘溶液,有蓝色出现.
【实验2】取水量A与熟石灰混合置于试管中,微热,产生刺激性气味的气体.该气体能使无色酚酞溶液变红.
【实验3】取一定量的A,溶于适量的水中,静止,过滤,分别取4份滤液.第一份滴加溶液pH<7;第二份滴加稀盐酸,无现象;第三份滴加氯化钡,无现象;第四份滴加硝酸银溶液,有白色沉淀,根据小意的实验探究,回答以下问题:
(1)【实验1】中刺激性气味的气体水溶液呈碱性(填“酸”“碱”或“中”);
(2)【实验2】第2,3份中的实验可分别排除CO32-,SO42-(填离子符号)的存在;
(3)以上实验证明,A主要是由NH4Cl(填化学式)和淀粉混合而成.
(4)为证明【实验3】第一份的现象,可通过测定NaCl溶液的pH=7作对比,从而推出上述盐溶液pH<7的原因与该盐中的NH4+(填离子符号)有关;
(5)第四份滴加硝酸银溶液反应的方程式为NH4Cl+AgNO3═AgCl↓+NH4NO3.
分析 根据电池中的成分、物质的性质进行分析解答,氨气有刺激性气味,水溶液呈碱性,碳酸盐遇酸化气;硝酸银能与氯离子结合产生氯化银沉淀,据此解答.
解答 解:(1)产生的有刺激性气味的气体是氨气,其水溶液呈碱性,故填:碱;
(2)滴加盐酸无现象,说明不含有碳酸根离子,滴加氯化钡无现象,说明不含有硫酸根离子,故填:CO32-,SO42-;
(3)滴加硝酸银溶液有白色沉淀生成,说明含有氯离子,故A是由氯化铵和淀粉混合制成的,故填:NH4Cl;
(4)由于氯化钠的水溶液呈中性,故盐溶液pH<7的原因与该盐中的铵根离子有关,故填:NH4+;
(5)加入硝酸银与氯化铵反应生成氯化银沉淀和硝酸铵,故填:NH4Cl+AgNO3═AgCl↓+NH4NO3.
点评 本题通过电池成分的实验探究,考查了常见离子的检验以及化学方程式的书写,完成此题,可以依据已有的知识进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.某样化学兴趣小组的同学在实验室发现一盛石灰水的试剂瓶,瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
【提出问题】白色粉末成分的猜想和成因分析.
【作出猜想】猜想Ⅰ:可能是CaCO3;原因是石灰水与空气中的CO2反应.
猜想Ⅱ:可能是Ca(OH)2 ;原因是溶剂蒸发,石灰水中的溶质结晶析出.
猜想Ⅲ:还可能是Ca(OH)2和CaCO3;原因是石灰水会与空气中的CO2反应,且溶剂蒸发时,石灰水中的溶质会结晶析出.
【实验探究】甲同学取白色粉末于试管中,加少量的水振荡,发现试管底部有白色固体.于是他得出白色固体粉末是CaCO3的结论.乙同学认为甲同学的结论不严密,理由是Ca(OH)2微溶于水.
为了得出较严密的结论,他们进行了如表所示实验,请完成实验报告:
由上述实验可知,猜想Ⅲ是正确的.
【拓展反思】通过上述实验的探究,同学们向实验员提出了保存易变质溶液的下列建议,合理的是ab.
a、密封保存 b、使用前临时配制 c、禁止使用该试剂.
【提出问题】白色粉末成分的猜想和成因分析.
【作出猜想】猜想Ⅰ:可能是CaCO3;原因是石灰水与空气中的CO2反应.
猜想Ⅱ:可能是Ca(OH)2 ;原因是溶剂蒸发,石灰水中的溶质结晶析出.
猜想Ⅲ:还可能是Ca(OH)2和CaCO3;原因是石灰水会与空气中的CO2反应,且溶剂蒸发时,石灰水中的溶质会结晶析出.
【实验探究】甲同学取白色粉末于试管中,加少量的水振荡,发现试管底部有白色固体.于是他得出白色固体粉末是CaCO3的结论.乙同学认为甲同学的结论不严密,理由是Ca(OH)2微溶于水.
为了得出较严密的结论,他们进行了如表所示实验,请完成实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
| ?取上述试管中的上层清液,滴加1─2滴无色酚酞试液 | 溶液呈红色 | 白色粉末中含有Ca(OH)2 |
| ?往上述试管残留的白色固体中滴加稀盐酸 | 有气泡产生 | 白色粉末中含CaCO3 |
【拓展反思】通过上述实验的探究,同学们向实验员提出了保存易变质溶液的下列建议,合理的是ab.
a、密封保存 b、使用前临时配制 c、禁止使用该试剂.
12.以下对O2、CO2、SO2、MnO2四种物质的组成的说法中,正确的是( )
| A. | 都含有2个氧原子 | B. | 都含有氧分子 | C. | 都含有2个氧元素 | D. | 都含有氧元素 |
16.钢铁工业是国家工业的基础.某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识.请你回答下列社会实践活动小组感兴趣的问题:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80gFe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石1.97吨(结果保留两位小数).
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到lg白色沉淀.
①此钢样粉末中铁和碳的质量之比为700:3.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如了表所示(标准状况下,2gH2的体积为22.4L):
请根据表中数据计算稀硫酸中H2SO4的质量分数为24.5%.
③若在实验Ⅱ中继续加入mg钢样粉末,反应结束后剩余的全部固体质量为当m>1.406g,剩余固体质量为:(m-1.376)g;
当m≤1.406g,剩余固体质量为:(5.624+m)×$\frac{0.12}{28.12}$g(请用含m的代数式表示).
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80gFe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石1.97吨(结果保留两位小数).
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到lg白色沉淀.
①此钢样粉末中铁和碳的质量之比为700:3.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如了表所示(标准状况下,2gH2的体积为22.4L):
| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢禅的粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/g(标况下) | 1.120 | 2.240 | 2.800 |
③若在实验Ⅱ中继续加入mg钢样粉末,反应结束后剩余的全部固体质量为当m>1.406g,剩余固体质量为:(m-1.376)g;
当m≤1.406g,剩余固体质量为:(5.624+m)×$\frac{0.12}{28.12}$g(请用含m的代数式表示).
17.下列除杂(括号内为杂质,能溶于水的均为溶液)的实验过程都正确的是( )
| A | 二氧化碳(一氧化碳) | 通入少量氧气,点燃 |
| B | 硫酸铜(硫酸) | 加足量铜粉、过滤 |
| C | 烧碱(纯碱) | 加适量盐酸,然后蒸发结晶 |
| D | 硫酸钡(碳酸钡) | 加入足量稀盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |




 我国食品安全法规定有些食品不允许添加防腐剂,因此有些食品包装中有一个单独包装的保鲜剂.某化学兴趣小组成员将家中一包(如图1)放置一段时间的食品保鲜剂带到学校,并邀兴趣小组的同学在化学实验室进行探究:
我国食品安全法规定有些食品不允许添加防腐剂,因此有些食品包装中有一个单独包装的保鲜剂.某化学兴趣小组成员将家中一包(如图1)放置一段时间的食品保鲜剂带到学校,并邀兴趣小组的同学在化学实验室进行探究: