题目内容
13.重庆一中某化学小组为探究二氧化碳的制取及性质,设计了如下实验.
(1)A为实验室制取二氧化碳的实验,该反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)请用化学方程式解释D中紫色石蕊变红的原因二氧化碳能与水反应生成的碳酸呈酸性,若要证明大理石中含碳酸根离子,只需将D中试剂换为澄清的石灰水(填试剂名称).
(3)用两种方法收集气体时,测得B、C中氧气体积分数随时间的变化关系如图甲所示,你认为能(填“能”或“不能”)用排水法收集二氧化碳.下列关于C的措施中能减少二氧化碳在水中溶解量的是①③(填序号).
①在水面添加一层植物油 ②收集气体时不断振荡C ③用热水替换冷水
(4)已知:常温下1体积水最多溶解1体积二氧化碳,得到pH值约为5.6的饱和溶液.实检结束后,若测得D中溶液pH值小于5.6,则乙、丙、丁图象与E中变化相符合的是乙、丁(填序号).

(5)为判别E中NaOH是否还有剩余,应向E中加入的试剂有④(填序号).
①稀盐酸 ②氯化钡溶液 ③氢氧化钡溶液 ④硫酸铜溶液.
分析 (1)据实验室制取二氧化碳的原理解答;
(2)根据二氧化碳与水反应生成碳酸呈酸性、碳酸钙和盐酸反应生成使石灰水变浑浊的二氧化碳分析;
(3)根据图甲、气体的溶解度进行判断;
(4)根据E中二氧化碳与氢氧化钠反应生成碳酸钠和水,结合图,进行分析;
(5)根据氢氧化钠与硫酸铜反应的现象,进行分析.
解答 解:(1)二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取.其反应原理是CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)二氧化碳能与水反应生成碳酸,碳酸呈酸性,能使石蕊试液变红,若要证明大理石中含碳酸根离子,只需将D中试剂换为澄清的石灰水,因为A中产生的二氧化碳能使澄清的石灰水变浑浊;
(3)通过图甲知能用排水法收集二氧化碳;在水面添加一层植物油可防止二氧化碳溶于水,由于气体的溶解度随温度的升高而减小,用热水替换冷水可减少二氧化碳在水中溶解量;
(4)已知:常温下1体积水最多溶解1体积二氧化碳,得到pH值约为5.6的饱和溶液.实验结束后,若测得D中溶液pH值小于5.6,则乙、丙、丁图象与E中变化相符合的是乙丁.
(5)为判别E中NaOH是否还有剩余,应向E中加入的试剂有硫酸铜溶液.
故答案为:
(1)CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)二氧化碳能与水反应生成的碳酸呈酸性;澄清的石灰水;
(3)能、①③;
(4)乙丁;
(5)④.
点评 本题考查了常见气体的制取、干燥、除杂、收集及反应原理的书写等.综合性较强,在利用氧气的性质测定塑料的组成元素时,要注意区分各步操作的作用和目的,利用质量守恒定律进行相关问题的分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列离子结构示意图中,表示阳离子的是( )
| A. |  | B. |  | C. |  | D. |  |
1.设计对比实验是化学的重要方法,下列对比实验不能达到目的是( )
| 编号 | A | B | C | D |
| 实验设计 |  |  |  |  |
| 实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究分子的运动 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
| A. | A | B. | B | C. | C | D. | D |
8.某化学探究小组欲制取少量氢氧化钠溶液.他们把饱和石灰水加入盛有碳酸钠溶液的烧杯中,经充分搅拌、过滤,得到样品溶液.
(1)写出反应的化学方程式:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)小组同学对得到的样品溶液是否为纯净的氢氧化钠溶液产生怀疑,决定对其溶质成份进行探究.
【提出猜想】
猜想一:只含氢氧化钠
猜想二:含有氢氧化钠、氢氧化钙
猜想三:含有氢氧化钠、碳酸钠
【实验探究】小组同学发现,只要用反应物(饱和石灰水和碳酸铵溶液)就可以验证猜想.他们取少量样品溶液进行下列实验:
【交流讨论】甲同学认为要验证猜想二不正确,也可往样品溶液中通入二氧化碳气体;受该同学的启发,小组同学认为要验证猜想三正确,也可以在样品溶液中滴加盐酸.
【实验评价】乙同学往样品溶液中滴入盐酸,刚开始没有观察到明显现象,试分析原因稀盐酸先和氢氧化钠反应生成氯化钠和水.
(1)写出反应的化学方程式:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)小组同学对得到的样品溶液是否为纯净的氢氧化钠溶液产生怀疑,决定对其溶质成份进行探究.
【提出猜想】
猜想一:只含氢氧化钠
猜想二:含有氢氧化钠、氢氧化钙
猜想三:含有氢氧化钠、碳酸钠
【实验探究】小组同学发现,只要用反应物(饱和石灰水和碳酸铵溶液)就可以验证猜想.他们取少量样品溶液进行下列实验:
| 实验操作 | 实现现象 | 实验结论 |
① X是碳酸钠溶液 X是碳酸钠溶液 | 无明显现象 | 猜想二不正确 |
② Y是氢氧化钙溶液 Y是氢氧化钙溶液 | 产生白色沉淀 | 猜想三正确 |
【实验评价】乙同学往样品溶液中滴入盐酸,刚开始没有观察到明显现象,试分析原因稀盐酸先和氢氧化钠反应生成氯化钠和水.

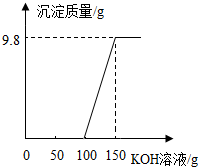 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答: