题目内容
14.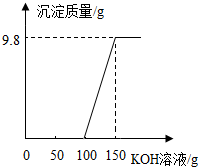 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答:(1)图中一开始加入KOH溶液没有沉淀的原因是氢氧化钾与硫酸反应生成硫酸钾和水.
(2)求所用的KOH溶液的溶质质量分数.
分析 根据硫酸和硫酸铜的混合物中加入氢氧化钾后,硫酸会先于氢氧化钾反应,然后硫酸铜才会与硫酸铜反应,然后依据图象中的数据进行分析.
解答 解:(1)图中一开始加入KOH溶液没有沉淀的原因是:氢氧化钾与硫酸反应生成硫酸钾和水;
(2)设所用的KOH溶液的溶质质量分数为x
CuSO4+2KOH=K2SO4+Cu(OH)2↓
112 98
50g×x 9.8g
$\frac{112}{50g×x}$=$\frac{98}{9.8g}$
x=22.4%
故答案为:(1)氢氧化钾与硫酸反应生成硫酸钾和水;
(2)所用的KOH溶液的溶质质量分数为22.4%.
点评 正确地分析图象是解题的关键.分析沉淀的质量与所滴入KOH溶液的质量关系曲线时,曲线起点表明混合溶液中硫酸恰好完全反应,曲线折点表明硫酸铜恰好与氢氧化钾完全反应.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
2.从分子的角度分析并解释下列事实,说法不正确的是( )
| A. | 碘酒是混合物-由不同种分子构成 | |
| B. | 气体受热膨胀-温度升高,分子自身体积变大 | |
| C. | 过氧化氢溶液加入二氧化锰能生成氧气,水中加入二氧化锰不能生成氧气-不同分子,性质不同 | |
| D. | 瓜果飘香-分子在不停地运动 |
9.两种抗胃酸药剂的主要成分及建议每次剂量见表:
(1)医生建议胃溃疡患者尽可能不要服用NaHO3的原因是:NaHCO3和HCl反应生成气态CO2,使胃内气压骤然升高;
(2)服用Mg(OH)2的药效比服用NaHCO3“强”的可能原因是:0.3gMg(OH)2比0.5gNaHCO3能中和更多的HCl,所以药效强于NaHCO3;Mg(OH)2和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3持久.
(3)科学研究表明,一定含量的Mg2+能导致人轻度腹泻.服用Mg(OH)2的患者可能出现“轻泻”的原因是Mg(OH)2和HCl反应生成MgCl2和H2O,出现“轻泻”和MgCl2或Mg2+有关.
| 主要成分 | NaHCO3 | Mg(OH)2 |
| 主要成分相对分子质量 | 84 | 58 |
| 建议每次剂量/g | 0.5 | 0.3 |
(2)服用Mg(OH)2的药效比服用NaHCO3“强”的可能原因是:0.3gMg(OH)2比0.5gNaHCO3能中和更多的HCl,所以药效强于NaHCO3;Mg(OH)2和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3持久.
(3)科学研究表明,一定含量的Mg2+能导致人轻度腹泻.服用Mg(OH)2的患者可能出现“轻泻”的原因是Mg(OH)2和HCl反应生成MgCl2和H2O,出现“轻泻”和MgCl2或Mg2+有关.
4.“清新指数”是空气清洁度的一种标准,下列做法不会对“清新指数”产生影响的是( )
| A. | 太阳能取暖 | B. | 燃放爆竹 | C. | 伐木造纸 | D. | 火力发电 |




 如图中A、B、C、D、E是初中化学中常见的物质,B、C、D、E是不同类别的无机化合物,且它们都含有同一种元素,已知A为红色固体,D可以用于除去铁锈,“-”表示物质在一定条件下可以发生化学反应,“→”表示在一定条件下一种物质可以转化成另一种物质,五种物质的关系如下:
如图中A、B、C、D、E是初中化学中常见的物质,B、C、D、E是不同类别的无机化合物,且它们都含有同一种元素,已知A为红色固体,D可以用于除去铁锈,“-”表示物质在一定条件下可以发生化学反应,“→”表示在一定条件下一种物质可以转化成另一种物质,五种物质的关系如下: