题目内容
17. 土壤污染会影响食品安全,我国的某地区曾发生“镉大米”事件.镉的相关信息:①镉元素位于第五周期ⅡB族.②镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱.③镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病.回答下列问题:
土壤污染会影响食品安全,我国的某地区曾发生“镉大米”事件.镉的相关信息:①镉元素位于第五周期ⅡB族.②镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱.③镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病.回答下列问题:(1)根据图中的相关信息,下列对镉元素判断不正确的是D(填字序号).
A.镉属于金属元素 B.一个镉原子中有48个质子
C.镉原子示意图中X=18 D.镉的相对原子质量为112.4g
(2)归纳镉单质的化学性质镉在潮湿空气中缓慢氧化,镉可溶于酸,但不溶于碱,有毒.
(3)“镉大米”主要出现在河水、土壤遭到镉污染的地区,消除“镉大米”需要从源头治理.目前河水治理的方法是:把适量Na2CO3投入被Cd2+污染的河水中,形成CdCO3沉淀,以降低河水中Cd2+的浓度.
①若某河段主要含有氯化镉,与碳酸钠反应的化学方程式为CdCl2+Na2CO3═2NaCl+CdCO3↓.
②25℃时,CdCO3的溶解度为2.8×10-6g,则1L河水中含Cd2+的质量为0.018mg(河水密度为1.0g/cm3,计算结果精确到0.001mg).国家要求水中Cd2+的含量的标准≤0.005mg/L,用Na2CO3处理的河水否(填“是”或“否”)达标.
分析 (1)根据硼元素在元素周期表中的相关信息,进行分析解答;
(2)根据化学性质的定义分析;
(3)①根据氯化镉与碳酸钠反应,写出反应的方程式;
②根据溶解度的意义进行计算分析.
解答 解:解:(1)A.由元素汉字名称的偏旁可辨别元素的种类,镉属于金属元素.故A正确
B.根据在原子中,原子序数=质子数=核电荷数=核外电子数可知,一个镉原子中有48个质子.故B正确;
C.根据在原子中,质子数=核外电子数可知,镉原子示意图中X=18.故C正确;
D.镉的相对原子质量为112.4,单位不是g,故D不正确;
(2)镉在潮湿空气中缓慢氧化,镉可溶于酸,但不溶于碱,有毒等是通过化学变化表现出来的性质,属于化学性质;
(3)①氯化镉与碳酸钠反应,生成了CdCO3沉淀和氯化钠,反应的方程式是:CdCl2+Na2CO3=2NaCl+CdCO3↓;
②由于25℃时,CdCO3的溶解度为2.8×10-6g,由于溶解CdCO3的质量很小,不影响溶液的质量,所以,则1L河水中含CdCO3的质量为:$\frac{1000g}{100g}$×2.8×10-6g=2.8×10-5g=2.8×10-2mg,含有Cd2+的质量为2.8×10-2mg×$\frac{112.4}{112.4+12+16×3}$×100%=0.018mg>0.005mg.
故填:(1)D;
(2)镉在潮湿空气中缓慢氧化,镉可溶于酸,但不溶于碱,有毒;
(3)①CdCl2+Na2CO3═2NaCl+CdCO3↓;②0.018;否.
点评 本题的综合性较强,涉及的知识点较多,了解元素周期表的意义,掌握物理性质与化学性质的区别、溶解度的含义是正确解答本题的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
2.体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.
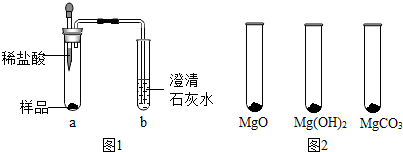
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清的石灰水变浑浊.则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解.此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】“镁粉”不只含有MgCO3.理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.

已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清的石灰水变浑浊.则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
【实验分析及结论】“镁粉”不只含有MgCO3.理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.
9.下列各组物质中,仅用一种试剂不能鉴别的一组是( )
| A. | Cu粉 Fe粉 Fe2O3粉 | |
| B. | Na2CO3 BaCl2 KNO3 | |
| C. | NaCl固体 CuSO4固体 CaCO3固体 | |
| D. | (NH4)2SO4 KNO3 NaNO3 |
6.下列实验方案能达到目的是( )
| A. |  探究燃烧条件 | B. |  探究MmO2对反应速率影响 | ||
| C. |  探究铁生锈 | D. |  探究溶解性影响因素 |
7.电视中的银簪子遇到所谓的毒物会变黑,实际上是生成了硫化银,古代的砒霜(三氧化二砷)实际上是用雄黄(三硫化二砷)加热得到的,纯度不高,里面含硫,因此用银簪子能试出来,化学方程式为2Ag+S═Ag2S,则下列说法正确的是( )
| A. | 银是氧化剂 | B. | 硫发生氧化反应 | C. | 银单质失去电子 | D. | 硫单质被氧化 |

 能源和环境问题日益成为人们关注的焦点.
能源和环境问题日益成为人们关注的焦点.