题目内容
9.下列各组物质中,仅用一种试剂不能鉴别的一组是( )| A. | Cu粉 Fe粉 Fe2O3粉 | |
| B. | Na2CO3 BaCl2 KNO3 | |
| C. | NaCl固体 CuSO4固体 CaCO3固体 | |
| D. | (NH4)2SO4 KNO3 NaNO3 |
分析 根据已有的物质的性质进行分析解答即可.
解答 解:A、Fe粉是黑色的,Cu粉和Fe2O3粉是红色的,加入盐酸,溶液变黄的是氧化铁,溶液不变色的是铜粉,使用一种试剂可以鉴别;
B、Na2CO3能与稀硫酸反应产生气体,BaCl2能与稀硫酸反应产生沉淀,KNO3与稀硫酸混合没有显现,故使用硫酸一种试剂可以鉴别;
C、加入水,NaCl固体溶于水,CuSO4固体溶于水溶液变蓝,CaCO3固体不溶解,故使用水一种试剂可以鉴别;
D、(NH4)2SO4、KNO3、NaNO3只使用一种试剂无法鉴别硝酸钾和硝酸钠;
故选D.
点评 本题考查了常见物质的鉴别,完成此题,可以依据物质的性质差异进行.

练习册系列答案
相关题目
4.在天平的两边放有两只烧杯,再向两只烧杯内分别加入100克9.8%的稀硫酸,向左边和右边分别加入等质量的铁和镁充分反应后天平依旧保持平衡,则加入的铁和镁的质量可能为( )
| A. | 2g | B. | 2.4g | C. | 5.6g | D. | 10g |
14.已知木炭还原氧化铜实验中发生的主要反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,某化学兴趣小组对该实验红色固体产物的成份(假设反应物已完全反应)作如下探究:
探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4═CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
探究二:测定该实验红色固体产物中Cu2O的含量
该化学兴趣小组经交流讨论后,设计了如下两方案:
方案一:称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.10g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
方案二:称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
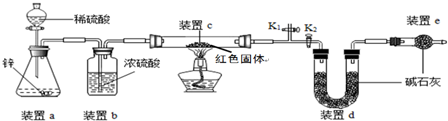
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位)
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①②③.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4═CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下两方案:
方案一:称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.10g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
方案二:称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.

(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位)
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①②③.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
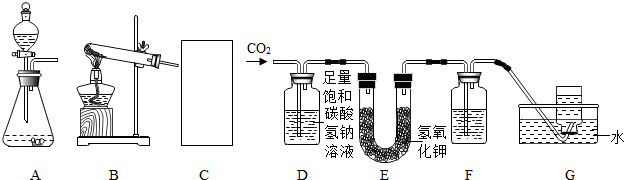
18. 研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:
研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:
(1)铁粉与水蒸气在高温下反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;其中还原剂为:铁粉.
(2)同学们对本实验成功的关键因素进行了分析:
①A处湿沙子的作用是提供水蒸汽;
②D处气体通过水的目的是 使氢气中混杂的水蒸汽遇冷液化,使氢气更纯净易于点燃.
(3)同学们还探索了铁粉用量与反应时间的关系,列表如下:(注:反应时间指加热一分钟后收集10毫升气体所需时间)从表中可以看出:铁粉用量与反应时间的关系是反应时间最短,反应速度最快.
 研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:
研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:(1)铁粉与水蒸气在高温下反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;其中还原剂为:铁粉.
(2)同学们对本实验成功的关键因素进行了分析:
①A处湿沙子的作用是提供水蒸汽;
②D处气体通过水的目的是 使氢气中混杂的水蒸汽遇冷液化,使氢气更纯净易于点燃.
(3)同学们还探索了铁粉用量与反应时间的关系,列表如下:(注:反应时间指加热一分钟后收集10毫升气体所需时间)从表中可以看出:铁粉用量与反应时间的关系是反应时间最短,反应速度最快.
| 铁粉质量/g | 0.2 | 0.4 | 0.6 | 0.8 |
| 第一次反应时间/S | 91 | 40 | 45 | 99 |
| 第二次反应时间/S | 84 | 44 | 50 | 82 |
19.如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据
(1)据如表可知二氧化锰与氯酸钾的质量比为$\frac{1}{10}$时,反应速率最快;
(2)通过分析可知,在化学反应中催化剂的用量不是越多越好.(填“是”或“不是”)
(3)二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的质量分数,所以反应速率受到影响;
(4)二氧化锰的用量过少时产生氧气的速率很慢,原因是MnO2与KClO3的接触面积小,因此催化作用不明显.
| 二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 | 2:3 | 1:1 | 2:1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
(2)通过分析可知,在化学反应中催化剂的用量不是越多越好.(填“是”或“不是”)
(3)二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的质量分数,所以反应速率受到影响;
(4)二氧化锰的用量过少时产生氧气的速率很慢,原因是MnO2与KClO3的接触面积小,因此催化作用不明显.
 托盘天平是一种实验室常用的称量用具,请回答下列问题:
托盘天平是一种实验室常用的称量用具,请回答下列问题: 土壤污染会影响食品安全,我国的某地区曾发生“镉大米”事件.镉的相关信息:①镉元素位于第五周期ⅡB族.②镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱.③镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病.回答下列问题:
土壤污染会影响食品安全,我国的某地区曾发生“镉大米”事件.镉的相关信息:①镉元素位于第五周期ⅡB族.②镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱.③镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病.回答下列问题: