题目内容
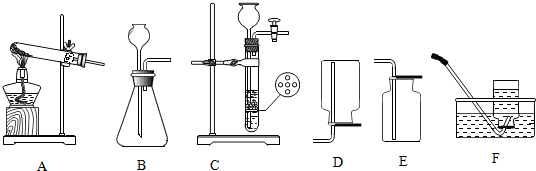
5.请结合下列实验装置,回答有关问题:
(1)写出图中标有字母的仪器名称:a长颈漏斗.
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是A,反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若某同学用E装置收集一瓶较纯净的氧气,当观察到气泡连续均匀冒出时开始收集.若用F装置收集氧气,则氧气应从左(填“左”或“右”)端导管通入.
(4)实验室制取二氧化碳的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,若要获得干燥的二氧化碳,并得到平稳的二氧化碳气流,应选择的装置组合是CGF.
(5)若实验室制取某气体用E装置收集,请推测该气体的物理、化学性质各一点:不易(或难)溶于水(物理性质)、不与水反应(化学性质).
(6)实验室用D装置制取气体,与B装置相比,D装置的优点是能控制反应的发生与停止.
分析 长颈漏斗方便加液体药品,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸干燥.能用排水法收集气体的原因是:不易(或难)溶于水、不与水反应;实验室用D装置制取气体,与B装置相比,D装置的优点是:能控制反应的发生与停止.
解答 解:(1)长颈漏斗方便加液体药品,故答案为:长颈漏斗
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;故答案为:A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
(3)用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时;若用F装置收集氧气,则氧气应从左端导管通入,因为氧气的密度比空气大,故答案为:气泡连续均匀冒出;左
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸干燥,因此应选择的装置组合是:CGF;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;CGF;
(5)能用排水法收集气体的原因是:不易(或难)溶于水、不与水反应;故答案为:不易(或难)溶于水、不与水反应
(6)实验室用D装置制取气体,与B装置相比,D装置的优点是:能控制反应的发生与停止;故答案为:能控制反应的发生与停止
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的干燥和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
| A. | 常温下,金属都是固体 | B. | 铜能与硫酸铜发生反应 | ||
| C. | 所有金属都能在氧气中燃烧 | D. | 合金通常情况下比单一金硬度大 |
| A化学与安全 | B化学与生活 |
| 稀酸溅入眼睛--用大量水冲洗 进入地窖--先做灯火实验 | 服用氢氧化钠--治疗胃酸过多 人体需要适量补钙--防止患甲状腺疾病 |
| C化学与能源 | D化学与环保 |
| 化石燃料--煤、石油和天然气 清洁能源--太阳能、风能等 | 减少汽车尾气污染--提倡使用公共交通等 减少温室气体排放--利用水力、核能发电 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 镁和盐酸反应 | B. | 天然气在空气中燃烧 | ||
| C. | 碳与二氧化碳的反应 | D. | 生石灰投入水中 |
| 实验目的 | 实验方法 | |
| A | 鉴别二氧化碳、氧气和空气 | 将燃着的木条分别伸入瓶中,观察现象 |
| B | 除去CO2 中的少量 CO | 点燃混合气体 |
| C | 除去MnO2中的C | 通过盛有CuO的硬质玻璃管,加热 |
| D | 区分硬水和软水 | 观察颜色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 五硼烷中含硼元素和氢元素 | |
| B. | 五硼烷的相对分子质量是64g | |
| C. | 五硼烷属于化合物 | |
| D. | 1个五硼烷分子由5个硼原子和9个氢原子构成 |