题目内容
14. 夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:
夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:(1)提出问题:“污渍爆炸盐”的主要化学成分是什么?
(2)查阅相关资料:资料主要信息如下:过碳酸钠俗称固体双氧水,白色晶体颗粒.过碳酸钠溶于水时,分解生成碳酸钠和过氧化氢,目前已成为世界广泛应斥的主要洗涤助剂之一.
(3)猜想:“污渍爆炸盐”的主要化学成分可能是过碳酸钠.
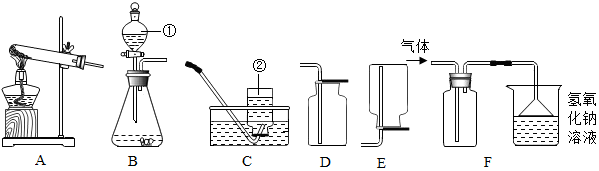
(4)设计与实验:小强同学设计的主要实验装置如图所示.
请你运用初中所学知识,帮助小强同学完成下列任务:
①在集气瓶中加入少量二氧化锰(黑色固体);在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液;在分液漏斗b中加入稀盐酸.
②打开分液漏斗a的活塞,放出适量溶液后,关闭活塞,生成大量无色气体,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,经检验该气体成分是氧气,第②步操作得到的结论:该盐的饱和溶液中含有双氧水.
③待第②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞,生成大量无色气体.将生成的气体通入澄清石灰水,验证生成气体的成分是二氧化碳.第③步操作得到的结论:该盐的变化溶液中含有碳酸根离子.
(5)实验的结论:小强认为:“污渍爆炸盐”溶于水生成碳酸钠和过氧化氢,“污渍爆炸盐”的主要化学成分是碳酸钠.
分析 本实验主要是通过验证过碳酸钠分解的产物来证明是否是这种物质.过碳酸钠溶于水时,分解生成碳酸钠和过氧化氢,碳酸钠能和盐酸反应生成二氧化碳气体,过氧化氢遇二氧化锰能分解生成氧气,验证生成物中有氧气和二氧化碳生成,可证明该物质是过碳酸钠.
解答 解:因为过碳酸钠溶于水时,能分解生成碳酸钠和过氧化氢,碳酸钠能和盐酸反应生成二氧化碳气体,过氧化氢遇二氧化锰能释放出氧气,从图示来看,黑色固体应该二氧化锰,分液漏斗b中应该加稀盐酸.检验氧气用带火星的木条,看是否复燃,检验二氧化碳用澄清石灰水,看是否变浑浊,所以
①在集气瓶中加入少量二氧化锰;在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液;在分液漏斗b中加入稀盐酸;
②打开分液漏斗a的活塞,放出适量溶液后,关闭活塞,生成大量无色气体,该反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,经检验该气体成分是氧气,第②步操作得到的结论:该盐的饱和溶液中含有双氧水;
③待第②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞,生成大量无色气体.将生成的气体通入澄清石灰水,验证生成气体的成分是二氧化碳.第③步操作得到的结论:该盐的变化溶液中含有碳酸根离子.
故答案为:①二氧化锰,稀盐酸;
②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,氧气,该盐的饱和溶液中含有双氧水;
③澄清石灰水,二氧化碳,该盐的变化溶液中含有碳酸根离子.
点评 通过本题,同学们可以学习验证物质的方法,就是通过化学反应,根据生成物来判断反应物.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
6.下列各组物质在pH=11的某无色溶液中,能大量共存的是( )
| A. | FeCl3、NaCl、KNO3 | B. | NaCl、NaOH、NaNO3 | ||
| C. | CaCl2、NaNO3、Na2CO3 | D. | KNO3、H2SO4、NaCl |
15.下列有关微粒的说法错误的是( )
| A. | 原子、分子、离子都是构成物质的微粒 | |
| B. | 钠原子失去1个电子形成钠离子 | |
| C. | 氢分子、氢原子、氢离子统称氢元素 | |
| D. | 构成物质的微粒是在不停地运动 |
 ,则该原子的电子层数为3层,质子数为12,该元素与地壳中含量最多元素和空气中含量最多元素能组成盐,写出该盐的化学式Mg(NO3)2.
,则该原子的电子层数为3层,质子数为12,该元素与地壳中含量最多元素和空气中含量最多元素能组成盐,写出该盐的化学式Mg(NO3)2.