题目内容
19.碘元素是人体必需的微量元素之一.(1)图1是元素周期表中碘元素的部分信息.碘元素属于非金属(填“金属”或“非金属”)元素,其相对原子质量为126.9.
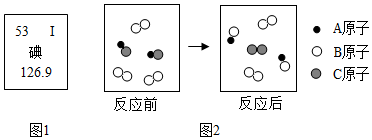
(2)某碘盐的主要成分为氯化钠和碘酸钾(KIO3),其中KIO3中I的化合价为+5价.
(3)上图2是某化学反应的微观图示.若A为氢原子、B为氯原子、C为碘原子,则该反应的化学方程式为2HI+Cl2=2HCl+I2.
分析 (1)碘属于非金属元素;元素周期表中每格提供的信息有原子序数(元素名称左上方数字)、元素符号、元素名称、相对原子质量(元素名称下方数字),进行解答;
(2)根据在化合物中正负化合价代数和为零,结合碘酸钾的化学式进行解答本题.
(3)根据质量守恒定律可以书写化学方程式.读图时注意凡是连在一起的才是一个分子,否则就不是.
解答 解:
(1)碘的偏旁部首为“石”,最外层电子数大于4个,是非金属元素,由碘元素在元素周期表中的相关信息,可知碘元素的相对原子质量是126.9;
(2)根据在化合物中正负化合价代数和为零,钾元素显+1,氧元素显-2,设碘元素的化合价是x,可知碘酸钾中碘元素的化合价:(+1)+x+(-2)×3=0,则x=+5.
(3)由化学反应的微观模拟示意图可知,该反应是碘化氢和氯气反应生成氯化氢和碘,反应的化学方程式为:2HI+Cl2=2HCl+I2.
答案:
(1)非金属;126.9;
(2)+5;
(3)2HI+Cl2=2HCl+I2
点评 本题考查学生对元素概念的理解及根据元素周期表中每格提供的信息进行解题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列实验现象中,描述正确的是( )
| A. | 木炭在氧气中剧烈燃烧,生成无色有刺激性气味的气体 | |
| B. | 白磷在空气中剧烈燃烧,生成大量白烟 | |
| C. | 铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 水通电分解,生成氢气的体积约是氧气体积的二分之一 |
4.下列对部分化学知识的归纳完全正确的一组是( )
| A、化学与生活 | B、化学对除杂的运用 |
| ①生活中常用加热煮沸的方法软化硬水 ②用燃烧的方法区分羊毛和涤纶 ③用水灭火降低了可燃物着火点 | ①用稀硫酸除去Ag中混有的Zn ②用点燃烧的方法除去CO2中混有的CO ③用盐酸除去Fe中的Fe2O3 |
| C、化学与安全 | D、化学对健康的影响 |
| ①炒菜油锅着火可以用锅盖盖灭 ②在室内放一盆水,可防止煤气中毒 ③夜间发现液化气泄漏开灯寻找泄漏源 | ①人体缺铁会引起贫血 ②用聚乙烯薄膜包装食品 ③食用蔬菜和水果来补充维生素 |
| A. | A | B. | B | C. | C | D. | D |
3.红枣包装中常使用一种“504双吸剂”,其成分为铁粉、生石灰等.实验小组同学对一包使用过的“504双吸剂”进行了如下探究.
【提出问题】久置后,固体的成分是什么?
【查阅资料】(1)铁与氯化铁溶液在常温下发生反应生成氯化亚铁;
(2)铁可以被磁铁吸引,Fe2O3、CaO、Ca(OH)2、CaCO3均不被磁铁吸引.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究】实验方案一:
【实验分析】
(1)酚酞溶液颜色发生改变是因为溶液中含有OH-(填离子符号)离子;甲同学认为通过实验不能得出一定含Ca(OH)2的结论,理由是CaO+H2O=Ca(OH)2(用化学方程式表示),该反应的基本类型为化合反应.
(2)乙同学认为通过实验不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.她设计实验方案二继续进行探究.
实验方案二:
【实验分析】
(1)④中发生的两个复分解反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑、Fe2O3+6HCl=2FeCl3+3H2O.
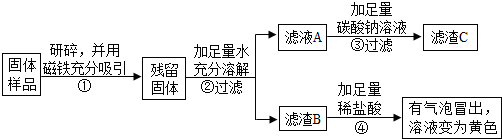
(2)通过实验二可确定固体样品中一定还含有Fe2O3.
(3)为确定固体样品中是否含有氢氧化钙,实验小组同学又经过实验测得上述残留固体总质量为1.66g,滤渣B质量为1.0g,滤渣C的质量为1.0g.
【实验结论】综合上述实验及所给数据,可判断实验小组同学们的猜想成立(填“成立”或“不成立”).
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂紫色石蕊试液.
【提出问题】久置后,固体的成分是什么?
【查阅资料】(1)铁与氯化铁溶液在常温下发生反应生成氯化亚铁;
(2)铁可以被磁铁吸引,Fe2O3、CaO、Ca(OH)2、CaCO3均不被磁铁吸引.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究】实验方案一:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取适量固体放于烧杯中,加足量蒸馏水溶解,静置后取上层清液,滴加无色酚酞溶液 | 固体溶解时烧杯外壁发烫 | 固体中一定含有①氧化钙 |
| 酚酞溶液变为②红色 | 固体中一定含有氢氧化钙 | |
| (2)另取少量固体放于试管中,滴加足量的盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有③铁,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有④CaCO3 |
(1)酚酞溶液颜色发生改变是因为溶液中含有OH-(填离子符号)离子;甲同学认为通过实验不能得出一定含Ca(OH)2的结论,理由是CaO+H2O=Ca(OH)2(用化学方程式表示),该反应的基本类型为化合反应.
(2)乙同学认为通过实验不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.她设计实验方案二继续进行探究.
实验方案二:
【实验分析】
(1)④中发生的两个复分解反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑、Fe2O3+6HCl=2FeCl3+3H2O.

(2)通过实验二可确定固体样品中一定还含有Fe2O3.
(3)为确定固体样品中是否含有氢氧化钙,实验小组同学又经过实验测得上述残留固体总质量为1.66g,滤渣B质量为1.0g,滤渣C的质量为1.0g.
【实验结论】综合上述实验及所给数据,可判断实验小组同学们的猜想成立(填“成立”或“不成立”).
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂紫色石蕊试液.
1.空气中能供给动植物呼吸的气体是( )
| A. | H2O | B. | O2 | C. | CO2 | D. | N2 |

 化学就在我们身边,它与我们的生活息息相关.
化学就在我们身边,它与我们的生活息息相关. 夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:
夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下: