题目内容
2.如图为为实验室常用的实验装置,请回答问题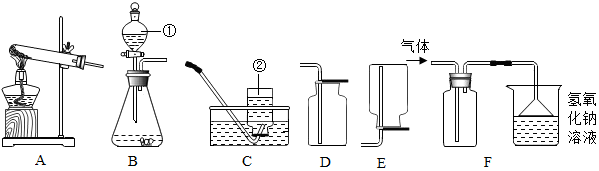
(1)写出装置的名称:①分液漏斗,②集气瓶
(2)组装装置完毕,装药前要检查装置的气密性;若用AC装置组合制取氧气,实验中观察到水槽中气泡时,开始收集连续均匀冒出,写出用高锰酸钾制取氧气的化学反应方程式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)二氧化硫是一种具有污染性的气体,实验室用亚硫酸钠固体和浓硫酸来制取,则进行该反应所选用的发生装置是B(填字母),收集二氧化硫选用的是装置F,因此可知二氧化硫的密度大于(填“大于”、“小于”或“等于”)空气的密度,F装置中的氢氧化钠溶液是足量的,原因是SO2+2NaOH═Na2SO3+H2O(用方程式表示)
分析 (1)熟记仪器的名称;
(2)实验装置组装后首先应检查装置的气密性,排水法收集氧气时,要等气泡连续均匀冒出再收集;
(3)制取装置包括加热和不需加热两种,实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制取二氧化硫气体,且同时生成硫酸钠和水,因此不需要加热;二氧化硫的密度比空气的大,溶于水且与水反应生成亚硫酸(H2SO3),因此只能用向上排空气法收集,根据F装置中的氢氧化钠溶液的作用写化学方程式.
解答 解:(1)①是分液漏斗,②是集气瓶;
(2)组装装置完毕,装药前要先检查装置的气密性,排水法收集氧气时,要等气泡连续均匀冒出再收集,高锰酸钾制取氧气的化学反应方程为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应,因此不需要加热;二氧化硫的密度比空气的大,溶于水且与水反应生成亚硫酸(H2SO3),因此只能用向上排空气法收集,二氧化硫有毒,需要用氢氧化钠溶液吸收;F装置中的氢氧化钠溶液的目的是吸收二氧化硫,化学方程式为SO2+2NaOH═Na2SO3+H2O.
故答案为:
(1)分液漏斗,集气瓶;
(2)检查装置的气密性;连续均匀冒出;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)B,F;大于,SO2+2NaOH═Na2SO3+H2O.
点评 本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 名校课堂系列答案
名校课堂系列答案| A. | 硬水与软水 ( 肥皂水,振荡) | B. | 二氧化碳与氮气(燃着的木条) | ||
| C. | 水与双氧水(加入少量二氧化锰粉末) | D. | 食盐水与蒸馏水(蒸发) |
| A. | 木炭在氧气中剧烈燃烧,生成无色有刺激性气味的气体 | |
| B. | 白磷在空气中剧烈燃烧,生成大量白烟 | |
| C. | 铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 水通电分解,生成氢气的体积约是氧气体积的二分之一 |
【提出问题】久置后,固体的成分是什么?
【查阅资料】(1)铁与氯化铁溶液在常温下发生反应生成氯化亚铁;
(2)铁可以被磁铁吸引,Fe2O3、CaO、Ca(OH)2、CaCO3均不被磁铁吸引.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究】实验方案一:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取适量固体放于烧杯中,加足量蒸馏水溶解,静置后取上层清液,滴加无色酚酞溶液 | 固体溶解时烧杯外壁发烫 | 固体中一定含有①氧化钙 |
| 酚酞溶液变为②红色 | 固体中一定含有氢氧化钙 | |
| (2)另取少量固体放于试管中,滴加足量的盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有③铁,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有④CaCO3 |
(1)酚酞溶液颜色发生改变是因为溶液中含有OH-(填离子符号)离子;甲同学认为通过实验不能得出一定含Ca(OH)2的结论,理由是CaO+H2O=Ca(OH)2(用化学方程式表示),该反应的基本类型为化合反应.
(2)乙同学认为通过实验不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.她设计实验方案二继续进行探究.
实验方案二:
【实验分析】
(1)④中发生的两个复分解反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑、Fe2O3+6HCl=2FeCl3+3H2O.
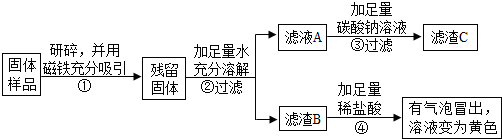
(2)通过实验二可确定固体样品中一定还含有Fe2O3.
(3)为确定固体样品中是否含有氢氧化钙,实验小组同学又经过实验测得上述残留固体总质量为1.66g,滤渣B质量为1.0g,滤渣C的质量为1.0g.
【实验结论】综合上述实验及所给数据,可判断实验小组同学们的猜想成立(填“成立”或“不成立”).
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂紫色石蕊试液.

 化学就在我们身边,它与我们的生活息息相关.
化学就在我们身边,它与我们的生活息息相关. 夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:
夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下: