题目内容
16.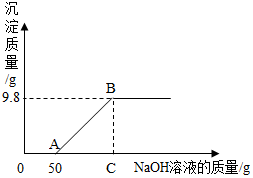 现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.求:
现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.求:(1)Cu(OH)2的相对分子质量是98.
(2)求混合溶液中硫酸铜的质量分数.
(3)生成最大沉淀量时所加入的氢氧化钠溶液的总质量.
分析 根据物质的化学式及其相对原子质量可以计算物质的相对分子质量;
氢氧化钠和稀硫酸反应生成硫酸钠和水,和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)Cu(OH)2的相对分子质量是:64+(16+1)×2=98.
故填:98.
(2)设硫酸铜质量为x,消耗氢氧化钠质量为y,
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓,
160 80 98
x y 9.8g
$\frac{160}{x}$=$\frac{80}{y}$=$\frac{98}{9.8g}$,
x=16g,y=8g,
混合溶液中硫酸铜的质量分数为:$\frac{16g}{200g}$×100%=8%,
答:混合溶液中硫酸铜的质量分数为8%.
(3)和硫酸铜反应的氢氧化钠溶液质量为:8g÷10%=80g,
生成最大沉淀量时所加入的氢氧化钠溶液的总质量为:50g+80g=130g,
答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为130g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
11.X、Y、Z三种金属,只有Y在自然界主要以单质形式存在,如果把X放入Z的硫酸盐溶液中,X表面有Z析出.据此判断这三种金属的活动性由强到弱的顺序为( )
| A. | Y>X>Z | B. | X>Z>Y | C. | Y>Z>X | D. | Z>X>Y |

 A、B、C、D、E、F 是初中化学常见的六种物质,其中A、B、C是单质,且C在常温下是黑色固体,F能使石蕊试液变红色.根据下图中物质的相互转化关系填写下列空白:
A、B、C、D、E、F 是初中化学常见的六种物质,其中A、B、C是单质,且C在常温下是黑色固体,F能使石蕊试液变红色.根据下图中物质的相互转化关系填写下列空白: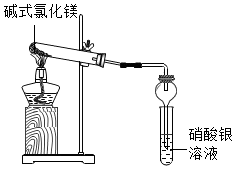 碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.