题目内容
化学与我们的生产密切相关,请试用所学过的化学知识解释下列现象或做法的原因(用化学方程式表示):
(1)人的胃液中含有少量盐酸,服用含少量细铁粉的补血药品,能治疗缺铁性贫血
(2)食品包装袋中的干燥剂(主要成分是氧化钙)有防潮作用
(3)用石灰浆粉刷墙壁,在一段时间内墙壁会“出汗”
(4))胃痛时吃几块苏打饼干(含纯碱)可减轻胃痛, .
(1)人的胃液中含有少量盐酸,服用含少量细铁粉的补血药品,能治疗缺铁性贫血
(2)食品包装袋中的干燥剂(主要成分是氧化钙)有防潮作用
(3)用石灰浆粉刷墙壁,在一段时间内墙壁会“出汗”
(4))胃痛时吃几块苏打饼干(含纯碱)可减轻胃痛,
考点:书写化学方程式、文字表达式、电离方程式
专题:化学用语和质量守恒定律
分析:首先根据反应原理找出反应物、生成物、反应条件,然后依据质量守恒定律书写化学方程式.
解答:解:(1)盐酸和铁反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(2)氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)氢氧化钙和二氧化碳反应生成白色的碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(4)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=NaCl2+H2O+CO2↑.
故答案为:(1)Fe+2HCl=FeCl2+H2↑;
(2)CaO+H2O=Ca(OH)2;
(3)Ca(OH)2+CO2=CaCO3↓+H2O;
(4)Na2CO3+2HCl=NaCl2+H2O+CO2↑.
(2)氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)氢氧化钙和二氧化碳反应生成白色的碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(4)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=NaCl2+H2O+CO2↑.
故答案为:(1)Fe+2HCl=FeCl2+H2↑;
(2)CaO+H2O=Ca(OH)2;
(3)Ca(OH)2+CO2=CaCO3↓+H2O;
(4)Na2CO3+2HCl=NaCl2+H2O+CO2↑.
点评:在解此类题时,首先分析应用的原理,然后找出反应物、生成物,最后结合方程式的书写规则书写方程式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质久置于敞口容器中,其质量增加且变质的是( )
| A、浓盐酸 | B、浓硫酸 |
| C、食盐 | D、氢氧化钠固体 |
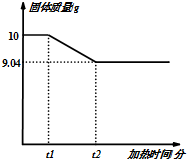 为测定某高锰酸钾样品中高锰酸钾的质量分数,某同学取10g样品加热到不再产生气体时止,加热前后,固体质量随加热时间变化关系如图所示:
为测定某高锰酸钾样品中高锰酸钾的质量分数,某同学取10g样品加热到不再产生气体时止,加热前后,固体质量随加热时间变化关系如图所示: