题目内容
19.小李对一种在空气中放置了一段时间的食品保鲜剂进行探究.【查找资料】(1)食物腐败是因为微生物只要得到养分,再加上充足的氧气和水,在适当条件下就会迅速生长.因此,只要缺少一种条件,就可以防止食物腐败.
(2)常见的具有吸水性的物质有以下几种:①生石灰②铁粉③氢氧化钠固体④硅胶(化学式SiO2•nH2O无色透明粒状固体,无毒无害);
【活动探究】(3)你认为①~④的物质中,不适合做食品干燥剂的是浓硫酸和氢氧化钠固体(填序号),原因是这两种物质均有强烈的腐蚀性;
(4)实验探究:
| 实验 | 操作 | 主要现象 | 结论与解释 |
| 实验1:初步判断 | 打开这种保鲜剂的包装袋,取少量样品于试管中,观察. | 该样品为黑色固体 | Ⅰ、该保鲜剂一定不是②⑤;(填保鲜剂序号) |
| 实验2:探究保鲜剂有效性 | 向实验1的试管中加入过量的稀盐酸,振荡. | 有气泡产生,溶液逐渐变成浅绿色 | Ⅱ、该保鲜剂④(填“有效”或“无效”); |
| 实验3:探究保鲜剂成分 | 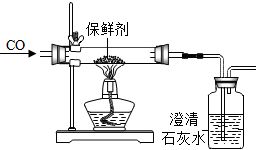 | 澄清石灰水变浑浊 | Ⅲ、综合实验2,该保鲜剂中一定含有的物质是Fe和Fe2O3; |
分析 浓硫酸和氢氧化钠固体具有强烈的腐蚀性;根据物质的物理性质可以判断具体的物质;铁能与盐酸反应产生气泡,一氧化碳还原氧化铁能产生使澄清石灰水变浑浊的二氧化碳;根据食品变质的条件可以找出防止食品变质的方法.
解答 解:
(3)初步探究:因为浓硫酸和氢氧化钠固体具有强烈的腐蚀性,不能用作食品干燥剂.故填:浓硫酸和氢氧化钠固体;因为这两种物质均有强烈的腐蚀性;
(4)实验探究:实验1:该保鲜剂一定不是生石灰和硅胶.因为样品是黑色的,生石灰和硅胶是无色的.故填:该保鲜剂一定不是生石灰和硅胶;
实验2:向试管中加入稀盐酸有气泡产生,说明样品中有铁粉,(溶液变成浅绿色,说明溶液中含有Fe2+;)故填:保鲜剂的成分是铁粉;
实验3:一氧化碳与保鲜剂反应产生使石灰水变浑浊的二氧化碳,说明保鲜剂部分变质成氧化铁,因此该保鲜剂中有:铁和氧化铁;
(5)实验2充分反应后,一定会生成是溶液呈浅绿色的氯化亚铁,还可能盐酸剩余;因保鲜剂中还含有氧化铁,与盐酸反应会生成氯化铁,
故溶液中的溶质可能是:HCl FeCl2或 HCl FeCl2 FeCl3
故答案为:
(3)初步探究:①③浓硫酸、氢氧化钠固体都具有腐蚀性.
(4)
| 实验 | 操作 | 主要现象 | 结论与解释 |
| 实验1:初步判断 | 打开这种保鲜剂的包装袋,取少量样品于试管中,观察. | 该样品为黑色固体 | Ⅰ、该保鲜剂一定不是 ②⑤;(填保鲜剂序号) |
| 实验2:探究保鲜剂有效性 | 向实验1的试管中加入过量的稀盐酸,振荡. | 有气泡产生,溶液逐渐变成浅绿色 | Ⅱ、该保鲜剂 ④(填“有效”或“无效”); |
| 实验3:探究保鲜剂成分 |  | 澄清石灰水变浑浊 | Ⅲ、综合实验2,该保鲜剂中一定含有的物质是 Fe和Fe2O3; |
点评 解答本题要掌握各种物质的性质和实验现象、物质反应的程度等方面的内容,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
10.下列各组中的两种溶液混合,需要用酚酞溶液才能证明其发生了反应的是( )
| A. | NaOH溶液+HCl溶液 | B. | NaOH溶液+CuSO4溶液 | ||
| C. | Ca(OH)2溶液+Na2CO3溶液 | D. | Na2CO3溶液+H2SO4溶液 |
7.下列生产和生活中做法正确的是( )
| A. | 用铁矿石与焦炭在高炉内炼铁 | B. | 用汽油焚烧处理盗版光盘 | ||
| C. | 将活性炭放入硬水中使其软化 | D. | 用苏打治疗人体胃酸过多 |
8.春季是病毒性流感的高发季节,次氯酸(HClO)能起到杀菌消毒作用.根据下面消毒过程中发生反应的微观示意图,判断有关说法正确的是( )


| A. | 图示中共有四种分子 | B. | 此反应类型为中和反应 | ||
| C. | 该反应中氯元素的化合价不变 | D. | 图示不符合质量守恒定律 |
9. 分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U形玻璃管内为红墨水(开始时两端液面水平),如图所示,放置一段时间后,以下说法错误的是( )
分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U形玻璃管内为红墨水(开始时两端液面水平),如图所示,放置一段时间后,以下说法错误的是( )
 分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U形玻璃管内为红墨水(开始时两端液面水平),如图所示,放置一段时间后,以下说法错误的是( )
分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U形玻璃管内为红墨水(开始时两端液面水平),如图所示,放置一段时间后,以下说法错误的是( )| A. | 植物油用于隔绝氧气和水 | |
| B. | 两支试管中的铁片均被腐蚀 | |
| C. | U形玻璃管两端的液面变为右低左高 | |
| D. | U形玻璃管两端的液面变为左低右高 |



 化学反应中该原子比较容易得到(填“得到”或“失去”)电子变成S2-(填离子符号)
化学反应中该原子比较容易得到(填“得到”或“失去”)电子变成S2-(填离子符号) 表示的是Al3+(填离子符号);
表示的是Al3+(填离子符号);