题目内容
12.下列图象分别与选项中的操作相对应,其中合理的是( )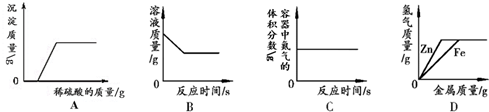
| A. | 向氢氧化钠和硝酸钡的混合溶液中加入足量的稀硫酸 | |
| B. | 向一定量氯化铜溶液中加入铝 | |
| C. | 红磷在装有空气的密闭容器中燃烧 | |
| D. | 向等质量、等质量分数的稀硫酸中分别加入锌粉和铁粉 |
分析 A、硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀;
B、根据铝与氯化铜的反应分析;
C、根据红磷在密闭容器中燃烧消耗氧气进行判断;
D、足量的铁与锌与相同的酸反应,生成氢气的质量相同,生成氢气的质量相同时消耗的新要比铁的质量多;
解答 解:A、硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀,一开始就会出现沉淀,而图象显示是过一段时间才出现沉淀,故错误;
B、向一定量氯化铜溶液中加入一定量铝,铝与氯化铜反应生成了氯化铝和铜,溶液的质量减轻,反应停止后不变;故正确;
C、红磷在密闭容器中燃烧消耗氧气,氮气的不变,故氮气的体积分数会慢慢变大一致反应停止,故错误;
D、在金属活动性顺序中,锌和铁都排在氢的前面,可以与盐酸发生置换反应生成氢气,生成氢气的质量相同时消耗的新要比铁的质量多,故不正确;
答案:B.
点评 此题是化学反应、及化学实验与图象知识的考查题,要结合反应和实验的过程与图象情况的走势联系起来,这是解题的关键所在.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
7.工业生产中,多数金属的冶炼过程都是采用热还原法.为测定某样品中三氧化钨的质量分数,我校化学课外活动小组的同学根据此原理,采用如图所示装置进行实验.

样品的质量为13.0g,化学方程式为WO3+3H2$\frac{\underline{\;高温\;}}{\;}$W+3H2O,样品中的杂质不参加反,WO3完全反应,C中吸收完全.小组同学经过规范的实验操作后得到了两组数据,记录如表所示.对于该实验,有以下几种说法:
①装置A和装置B中发生的反应均为置换反应;
②实验前应先向装置中通入氢气,防止加热时产生爆炸;
③反应前后装置B减少的质量为生成水的质量;
④该实验没有尾气处理装置,容易造成空气污染;
⑤利用实验前后装置B的总质量进行计算,得到的结果更准确;
⑥若B中的WO3没有完全反应,对测定结果没有影响
以上说法中,正确的是( )

样品的质量为13.0g,化学方程式为WO3+3H2$\frac{\underline{\;高温\;}}{\;}$W+3H2O,样品中的杂质不参加反,WO3完全反应,C中吸收完全.小组同学经过规范的实验操作后得到了两组数据,记录如表所示.对于该实验,有以下几种说法:
| 实验 | 装置的质量 | 实验前 | 实验后 |
| 第一组 | B装置的 总质量/g | 45.5 | 43.1 |
| 第二组 | C装置的 总质量/g | 100.5 | 103.3 |
②实验前应先向装置中通入氢气,防止加热时产生爆炸;
③反应前后装置B减少的质量为生成水的质量;
④该实验没有尾气处理装置,容易造成空气污染;
⑤利用实验前后装置B的总质量进行计算,得到的结果更准确;
⑥若B中的WO3没有完全反应,对测定结果没有影响
以上说法中,正确的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ③④⑥ | D. | ①②⑤ |
17.某化学课堂利用桌面上的试剂:氢氧化钠溶液、稀硫酸、氯化铜溶液,围绕“酸碱中和反应”进行探究活动.
【演示实验】甲小组:将稀硫酸加入到盛有氢氧化钠溶液的小烧杯中,再滴加少量氯化铜溶液,无蓝色沉淀出现.
乙小组:在盛有氢氧化钠溶液的小烧杯中,加入少量氯化铜溶液出现蓝色沉淀,逐滴滴加稀硫酸,边加搅拌至蓝色沉淀刚好消失.
【学生板演】氢氧化钠和稀硫酸反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O
【实验小结】
(1)甲小组证明发生了中和反应的现象是滴加少量氯化铜溶液,无蓝色沉淀出现.
(2)乙组同学认为他们不仅证明了中和反应的发生,而且确定了反应的终点,丙组同学提出异议,他们认为少量的氯化铜只能反应部分氢氧化钠,故不能确定反应终点,丙组同学的说法是否正确?其原因是正确,氢氧化钠溶液有剩余,.
【实验拓展】大家对甲组同学实验产物中是否还有稀硫酸进行了探究.
【查阅资料】酸和碱完全中和生成盐和水,盐溶液有酸碱性,强酸强碱形成的盐显中性,如氯化钠溶液;强酸强碱形成的盐显酸性,如氯化铜溶液,强酸强碱形成的盐显碱性,如碳酸钠溶液.
【实验及结论】
【评价反思】经过反思同学们发现实验方案中有一个是错误的,错误的原因是:氯化铜的水溶液也显酸性.
【演示实验】甲小组:将稀硫酸加入到盛有氢氧化钠溶液的小烧杯中,再滴加少量氯化铜溶液,无蓝色沉淀出现.
乙小组:在盛有氢氧化钠溶液的小烧杯中,加入少量氯化铜溶液出现蓝色沉淀,逐滴滴加稀硫酸,边加搅拌至蓝色沉淀刚好消失.
【学生板演】氢氧化钠和稀硫酸反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O
【实验小结】
(1)甲小组证明发生了中和反应的现象是滴加少量氯化铜溶液,无蓝色沉淀出现.
(2)乙组同学认为他们不仅证明了中和反应的发生,而且确定了反应的终点,丙组同学提出异议,他们认为少量的氯化铜只能反应部分氢氧化钠,故不能确定反应终点,丙组同学的说法是否正确?其原因是正确,氢氧化钠溶液有剩余,.
【实验拓展】大家对甲组同学实验产物中是否还有稀硫酸进行了探究.
【查阅资料】酸和碱完全中和生成盐和水,盐溶液有酸碱性,强酸强碱形成的盐显中性,如氯化钠溶液;强酸强碱形成的盐显酸性,如氯化铜溶液,强酸强碱形成的盐显碱性,如碳酸钠溶液.
【实验及结论】
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取甲组反应后溶液,滴加过量碳酸钠溶液 | 有气泡产生 | 反应后硫酸溶液过量 |
| 方案二 | 取少量甲组反应后溶液,滴在pH试纸上, | 试纸变色,对比比色卡,pH<7 |
4.化学反应前后,肯定不变的是( )
| A. | 分子的种类 | B. | 原子的种类和数目 | ||
| C. | 分子的数目 | D. | 物质的种类 |
2.下列实验方案达到目的是( )
| 序号 | 实验目的 | 实验方案 |
| A | 区分食盐水和CaCl2溶液 | 取样,分别加肥皂水,振荡 |
| B | 制备CO2 | 选用块状石灰石和稀硫酸反应 |
| C | 测溶液的酸碱度 | 取样,滴加石蕊溶液 |
| D | 除去CO2中的少量的CO | 通入过量的氧气,点燃 |
| A. | A | B. | B | C. | C | D. | D |