题目内容
1.如图表示实验室用稀 H2SO4、CuO、Fe 粉三种物质,制取铜的两种实验方案.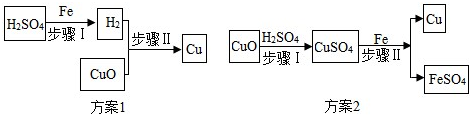
(1)若按方案1制取铜,步骤Ⅱ反应的现象是什么?
(2)若按方案2制取铜,请写出步骤Ⅱ发生反应的化学方程式.
(3)两种方案比较,哪种方案更好?请说明理由.
分析 (1)根据氢气和氧化铜反应生成铜和水进行解答;
(2)根据铁和硫酸铜反应生成硫酸亚铁和铜进行解答;
(3)根据判断一个实验方案的好坏要从操作简便,结果明显,环保,节能等角度考虑.
解答 解:(1)氢气和氧化铜反应生成铜和水,方案1制取铜,步骤II反应的现象是黑色固体变为红色,且有水珠出现;
(2)硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
(3)方案一在用氢气还原氧化铜需要加热,需要通入大于实际量的氢气,操作复杂,方案二不需加热,操作方便安全,且节省原料、环保,所以比方案一要优越.
故答案为:(1)黑色固体变为红色,且有水珠出现;
(2)Fe+CuSO4=FeSO4+Cu;
(3)方案2好,安全、节能.
点评 本题从化学方程式,实验方案的评价选择等方面进行了考查,综合性强,是一道很好的中考题.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
11.让“阅兵蓝”成为天空常态,下列做法不合理的是( )
| A. | 提倡使用清洁能源 | B. | 加高烟窗排放工业废气 | ||
| C. | 不焚烧垃圾 | D. | 骑自行车出行 |
12.下列图象分别与选项中的操作相对应,其中合理的是( )
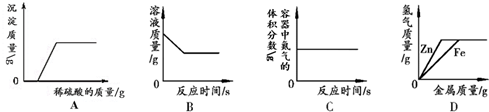

| A. | 向氢氧化钠和硝酸钡的混合溶液中加入足量的稀硫酸 | |
| B. | 向一定量氯化铜溶液中加入铝 | |
| C. | 红磷在装有空气的密闭容器中燃烧 | |
| D. | 向等质量、等质量分数的稀硫酸中分别加入锌粉和铁粉 |
9.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:
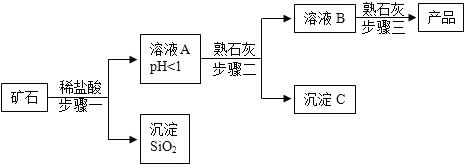
(1)请写出步骤一中发生反应的化学方程式:MgO+2HCl═MgCl2+H2O(任写一个)
(2)溶液A中所含的阳离子有Mg2+、Fe3+、Cu2+、H+(填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
步骤二中加入熟石灰,调节溶液的pH范围为6.7~9.1
(4)3个步骤中均用到的操作是过滤
(5)步骤三中生成产品的化学方程式为MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.

(1)请写出步骤一中发生反应的化学方程式:MgO+2HCl═MgCl2+H2O(任写一个)
(2)溶液A中所含的阳离子有Mg2+、Fe3+、Cu2+、H+(填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 4.2 | 9.1 |
| 完全沉淀 | 3.2 | 6.7 | 11.1 |
(4)3个步骤中均用到的操作是过滤
(5)步骤三中生成产品的化学方程式为MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
6.某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为 60%,将 50g 混合物高温煅烧至质量不再改变,则生成二氧化碳的质量是( )
| A. | 6 g | B. | 8 g | C. | 13.2 g | D. | 20 g |
13.一定质量的物质甲(相对分子质量是 90)在氧气中完全燃烧,消耗了 6.4g 氧气,同时生成了 5.6g CO、4.4g CO2和 5.4g H2O,则下列对甲的说法中正确的是( )
| A. | 只含有碳、氢两种元素 | |
| B. | 一定含有碳、氢元素、可能含有氧元素 | |
| C. | 碳元素的质量分数为40% | |
| D. | 若相同质量的甲在 8.6g氧气中完全燃烧,只生成二氧化碳和水 |
 如图所示,小明和小红在做金属活动性顺序的探究实验,他们将铁钉加入到硫酸铜溶液中,观察到铁钉表面有气泡产生,一段时间后,在铁钉表面附着了红色的固体.
如图所示,小明和小红在做金属活动性顺序的探究实验,他们将铁钉加入到硫酸铜溶液中,观察到铁钉表面有气泡产生,一段时间后,在铁钉表面附着了红色的固体.