题目内容
18.化学课上,同学们做了如下两个实验.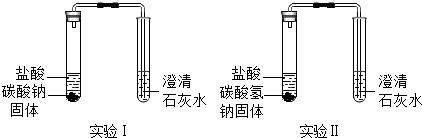
| 实验装置 | 实验现象 | 实验结论 |
| | 实验Ⅰ、Ⅱ中均观察到:白色固体逐渐减少,有气泡冒出;澄清石灰水变浑浊. | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是NaHCO3+HCl=NaCl+H2O+CO2↑. |
【提出问题】两个实验过程中,温度变化的原因是什么?
【猜想与假设】甲同学认为:Na2CO3和盐酸反应为放热反应,而NaHCO3和盐酸反应为吸热反应.
乙同学认为甲的猜想有不足之处.
【设计实验】乙同学欲通过实验进行研究,实验步骤如下:
①分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度t1
②静置,测量温度t2
③分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度t3
【实验记录】多次实验后取平均值记录如下:
| t1/℃ | t2/℃ | t3/℃ | |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)甲同学猜想的不足之处是没有考虑固体溶解时的温度变化.通过步骤①得到的结论是Na2CO3固体溶解放热,NaHCO3固体溶解吸热.
(2)通过步骤②和③得到的结论是:Na2CO3和NaHCO3与盐酸反应都是放热反应.
【反思与评价】老师指出乙的设计仍存在不足,并补充做如下实验:向盛有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(1)此实验的目的是探究盐酸稀释过程中的温度变化.
(2)结合此次探究活动,你认为下列说法不正确的是B(填序号).
A.盐酸的稀释过程是放热过程
B.NaHCO3与盐酸的反应是放热反应
C.实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关.
分析 根据已有的知识进行分析,碳酸钠和碳酸氢钠都能与盐酸反应产生气体;甲同学使用的是固体进行实验,没有考虑固体溶于水时的温度变化;乙同学进行实验时没有考虑盐酸稀释过程中的温度变化,据此解答.
解答 解:碳酸钠和碳酸氢钠都能与盐酸反应产生气体,故会观察到有气泡产生,碳酸氢钠能与盐酸反应产生氯化钠、水和二氧化碳,故填:
| 实验装置 | 实验现象 | 实验结论 |
 | 实验Ⅰ、Ⅱ中均观察到:白色固体逐渐减少,有气泡冒出;澄清石灰水变浑浊. | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是 NaHCO3+HCl=NaCl+H2O+CO2↑ |
【反思与评价】(1)向盛有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃,目的是探究盐酸稀释过程中温度是否变化,故填:探究盐酸稀释过程中的温度变化;
(2)A、盐酸中加水稀释,温度升高,说明盐酸稀释过程中放出热量,正确;B、盐酸和碳酸氢钠反应中温度升高可能是盐酸稀释放出的热量,错误;C、实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关,正确;故填:B.
点评 本题考查的是常见的物质的性质比较实验,完成此题,可以依据已有的物质的性质以及题干提供的信息进行.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
6. 如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
 如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | t2℃时,甲、丙两种物质的饱和溶液中溶质的质量分数相等 | |
| C. | 若甲物质中混有少量的乙物质,可用蒸发结晶的方法提纯甲 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
3.结合如图你认为下列有关说法不合理的是( )


| A. | 自然界的水没有绝对纯净的,除水外均含有其他物质 | |
| B. | 如图的河水,经过过滤就可以达到饮用的标准 | |
| C. | 水是生命之源,我们应该爱护水资源 | |
| D. | 农药化肥的不合理使用,会导致水体污染 |
10.用粒子知识对下列一些事实的解释正确的是( )
| 事实 | 解释 | |
| A | 氖气和氦气化学性质相似 | 氖原子和氦原子最外层电子数相同 |
| B | 氯化钠固体不导电 | 因为没有带电的离子 |
| C | 空气比水容易被压缩 | 混合物比纯净物分子间隔大 |
| D | 物质的热胀冷缩 | 粒子间的间隔随温度的改变而改变 |
| A. | A | B. | B | C. | C | D. | D |
1.铁和铝是我们生活中常见的两种金属.某化学小组欲探究铁和铝的金属活动性强弱,设计如下实验方案:
(1)小组同学取来相同质量的铁、铝分别放入起始温度相同、体积也相同的10%稀盐酸中,一开始观察到的现象是铁表面有气泡,而铝无明显现象,小明于是得出与课本中相反的结论.小文同学马上提出质疑,你认为质疑的主要理由是铝表面有一层致密的氧化铝(或未打磨金属).一开始铝表面现象不明显,但此时发生的化学方程式为Al2O3+6HCl=2AlCl3+3H2O.为了达到实验目的,除了以上条件相同外,你认为还要控制2中金属的表面积或颗粒大小相同.
(2)他们改正后重新实验,得出与课本相同的结论是铝的活动性比铁强.请写出铁与稀盐酸反应的化学方程式Fe+2HCl=FeCl2+H2↑.
【应用拓展】请再设计一个与上述不同的实验方案,也能得到以上相同的正确结论.
小组同学通过对生活中金属制品的观察和课本所学的知识,仍能得出同样的正确结论.你的解释是铝在常温下就能与氧气反应形成一层致密的氧化铝薄膜,而铁在常温下与氧气几乎不反应.
(1)小组同学取来相同质量的铁、铝分别放入起始温度相同、体积也相同的10%稀盐酸中,一开始观察到的现象是铁表面有气泡,而铝无明显现象,小明于是得出与课本中相反的结论.小文同学马上提出质疑,你认为质疑的主要理由是铝表面有一层致密的氧化铝(或未打磨金属).一开始铝表面现象不明显,但此时发生的化学方程式为Al2O3+6HCl=2AlCl3+3H2O.为了达到实验目的,除了以上条件相同外,你认为还要控制2中金属的表面积或颗粒大小相同.
(2)他们改正后重新实验,得出与课本相同的结论是铝的活动性比铁强.请写出铁与稀盐酸反应的化学方程式Fe+2HCl=FeCl2+H2↑.
【应用拓展】请再设计一个与上述不同的实验方案,也能得到以上相同的正确结论.
| 操作方法 | 实验现象 |
| 将打磨过的铝放入硫酸亚铁溶液中,观察现象 或打磨过的铁钉放入硫酸铝溶液中,观察现象 | 铝表面出现固体,溶液由浅绿色慢慢变成无色 或无明显变化 |
2.下列变化中,属于化学变化的是( )
| A. | 风力发电 | B. | 石油蒸馏 | C. | 净化水 | D. | 煤的干馏 |

