题目内容
6. 如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | t2℃时,甲、丙两种物质的饱和溶液中溶质的质量分数相等 | |
| C. | 若甲物质中混有少量的乙物质,可用蒸发结晶的方法提纯甲 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
分析 A、据溶解度曲线可比较同一温度下不同物质的溶解度大小;
B、据饱和溶液中溶质的质量分数计算解答;
C、据溶解度曲线可知物质的溶解度受温度影响情况,进而分析提纯物质的方法;
D、曲线上的点所对应的溶液为此温度下恰好饱和的饱和溶液,而曲线下方的点则为此时的不饱和溶液.根据溶解度受温度的变化情况,可以判断要将组成在N点的A溶液转变为M点的溶液采取的方法.
解答 解:A、由溶解度曲线可知:t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲,正确;
B、饱和溶液中溶质质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,而t2℃时,甲、丙两种物质的溶解度相等,所以饱和溶液中溶质的质量分数相等,正确;
C、甲物质的溶解度受温度影响较大,乙物质的溶解度受温度影响较小,所以甲物质中混有少量乙物质,可用降温结晶的方法提纯甲,故错误;
D、甲物质的溶解度随温度的升高而增大,所以要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂或添加溶质的方法,正确;
故选:C.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
16.“低碳生活”倡导我们在生活中所耗用的能量、材料要尽量减少,从而降低二氧化碳的排放量,下列做法不符合“低碳生活”理念的是( )
| A. | 椒江区设立公共自行车,倡导市民多骑自行车,少开汽车 | |
| B. | 学校推行美术、音乐等书籍循环使用 | |
| C. | 部分学生稍微有点热就开空调、电风扇 | |
| D. | 废纸统一回收再生 |
17.实验室制取二氧化碳,可直接采用的发生装置是( )
| A. |  | B. |  | C. |  | D. |  |
14.化学学习让我们有了很多收获,下列归纳总结完全正确的一组是( )
| 选项 | 实验目的 | 方案 |
| A | 鉴别稀盐酸和稀硫酸 | 取样,滴加紫色石蕊,观察现象 |
| B | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、过滤、蒸发 |
| C | 除去CaO中的CaCO3 | 高温加热到固体质量不变 |
| D | 探究Mg、Ag、Cu金属的 活动性顺序 | 将两根光亮的镁条分别伸入 硫酸铜溶液和硝酸银溶液中 |
| A. | A | B. | B | C. | C | D. | D |
11. 20℃时,在密闭(与外界不发生热交换)容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )
20℃时,在密闭(与外界不发生热交换)容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )
 20℃时,在密闭(与外界不发生热交换)容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )
20℃时,在密闭(与外界不发生热交换)容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )| A. | 该反应是放热反应 | |
| B. | 恰好中和时溶液温度达到最高点 | |
| C. | 恰好中和时消耗硫酸的质量是m g | |
| D. | 若用浓硫酸代替稀硫酸,则恰好反应时溶液温度为T℃ |
18.化学课上,同学们做了如下两个实验.

在实验过程中用手触摸试管,发现盛Na2CO3的试管变热,盛NaHCO3的试管变冷
【提出问题】两个实验过程中,温度变化的原因是什么?
【猜想与假设】甲同学认为:Na2CO3和盐酸反应为放热反应,而NaHCO3和盐酸反应为吸热反应.
乙同学认为甲的猜想有不足之处.
【设计实验】乙同学欲通过实验进行研究,实验步骤如下:
①分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度t1
②静置,测量温度t2
③分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度t3
【实验记录】多次实验后取平均值记录如下:
【分析与结论】
(1)甲同学猜想的不足之处是没有考虑固体溶解时的温度变化.通过步骤①得到的结论是Na2CO3固体溶解放热,NaHCO3固体溶解吸热.
(2)通过步骤②和③得到的结论是:Na2CO3和NaHCO3与盐酸反应都是放热反应.
【反思与评价】老师指出乙的设计仍存在不足,并补充做如下实验:向盛有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(1)此实验的目的是探究盐酸稀释过程中的温度变化.
(2)结合此次探究活动,你认为下列说法不正确的是B(填序号).
A.盐酸的稀释过程是放热过程
B.NaHCO3与盐酸的反应是放热反应
C.实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关.

| 实验装置 | 实验现象 | 实验结论 |
| | 实验Ⅰ、Ⅱ中均观察到:白色固体逐渐减少,有气泡冒出;澄清石灰水变浑浊. | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是NaHCO3+HCl=NaCl+H2O+CO2↑. |
【提出问题】两个实验过程中,温度变化的原因是什么?
【猜想与假设】甲同学认为:Na2CO3和盐酸反应为放热反应,而NaHCO3和盐酸反应为吸热反应.
乙同学认为甲的猜想有不足之处.
【设计实验】乙同学欲通过实验进行研究,实验步骤如下:
①分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度t1
②静置,测量温度t2
③分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度t3
【实验记录】多次实验后取平均值记录如下:
| t1/℃ | t2/℃ | t3/℃ | |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)甲同学猜想的不足之处是没有考虑固体溶解时的温度变化.通过步骤①得到的结论是Na2CO3固体溶解放热,NaHCO3固体溶解吸热.
(2)通过步骤②和③得到的结论是:Na2CO3和NaHCO3与盐酸反应都是放热反应.
【反思与评价】老师指出乙的设计仍存在不足,并补充做如下实验:向盛有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(1)此实验的目的是探究盐酸稀释过程中的温度变化.
(2)结合此次探究活动,你认为下列说法不正确的是B(填序号).
A.盐酸的稀释过程是放热过程
B.NaHCO3与盐酸的反应是放热反应
C.实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关.
15.A、在宏观、微观和符号之间建立联系是化学学科的特点.
甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于表:
(1)请你画出丁物质的微观示意图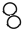 ;
;
(2)构成甲物质的粒子是水分子;
(3)四种物质中属于氧化物的是CO、H2O(填化学式),请你从微观角度描述判断的依据:均由同种分子构成,且分子又都是由氧原子和另一种原子构成的.
甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于表:
| 物质 | 甲 | 乙 | 丙 | 丁 | 图例: |
| 化学式 | H2O | C | ? | H2 | |
| 微观示意图 |  |  |  | ? |
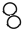 ;
;(2)构成甲物质的粒子是水分子;
(3)四种物质中属于氧化物的是CO、H2O(填化学式),请你从微观角度描述判断的依据:均由同种分子构成,且分子又都是由氧原子和另一种原子构成的.
10.工业上用电解饱和食盐水的方法来制取烧碱,将制得的烧碱溶液再经浓缩、蒸发等操作制成烧碱固体.在生产过程中,原料通常不能完全转化.另外,如果烧碱固体长时间存放在仓库里,也可能会变质.
(1)电解饱和食盐水制得烧碱的同时,还生成氯气和另一种气体,该反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)现从仓库中取来烧碱样品,该样品除了可能含有纯碱杂质外,还可能含有氯化钠杂质.某化学小组决定探究样品中是否含有这两种杂质.
①查阅资料:实验中若产生微溶物质,通常会以沉淀形式存在.
②实验设计
③交流与反思
a.烧碱固体长时间在仓库存放会变质的原因是(用化学反应方程式表示)2NaOH+CO2=Na2CO3+H2O.
b.实验后若测得废液的pH<7,则废液呈酸性(填“酸性”、“中性”或“碱性”),从操作简单和经济环保的角度考虑,应向废液中加入稍过量的石灰石,然后再倒入下水道中.
(1)电解饱和食盐水制得烧碱的同时,还生成氯气和另一种气体,该反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)现从仓库中取来烧碱样品,该样品除了可能含有纯碱杂质外,还可能含有氯化钠杂质.某化学小组决定探究样品中是否含有这两种杂质.
①查阅资料:实验中若产生微溶物质,通常会以沉淀形式存在.
②实验设计
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| a.取少量样品于试管中,并加入过量的稀硝酸. | 有气泡生成. | 样品中有纯碱. |
| b.再向步骤Ⅰ中所得的溶液加入硝酸银溶液. | 有白色沉淀生成. | 样品中有氯化钠. |
a.烧碱固体长时间在仓库存放会变质的原因是(用化学反应方程式表示)2NaOH+CO2=Na2CO3+H2O.
b.实验后若测得废液的pH<7,则废液呈酸性(填“酸性”、“中性”或“碱性”),从操作简单和经济环保的角度考虑,应向废液中加入稍过量的石灰石,然后再倒入下水道中.
