题目内容
16.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸,进行实验探究,但实验室现有的是溶质质量分数为98%的浓硫酸.请完成下列问题:(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?
(2)我国约在南北朝时就开始冶炼黄铜.黄铜是铜和锌的合金(Cu-Zn),它可用来制造机器、电器零件及日用品.为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将上述配制好的稀硫酸25g分五次加入到8g黄铜样品粉末中,每次充分反应后.测定生成氢气的质量,实验数据见下表:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀硫酸的质量 (g) | 5 | 5 | 5 | 5 | 5 |
| 生成氢气的质量(g) | 0.02 | 0.04 | m | 0.08 | 0.08 |
(1)m=0.06.
(2)此黄铜样品中锌的质量分数是多少?
分析 溶液稀释前后,溶质质量不变;
新和稀硫酸反应生成硫酸锌和氢气,根据表中数据可以判断生成氢气的质量,根据氢气的质量可以计算锌的质量,进一步可以计算此黄铜样品中锌的质量分数.
解答 解:设需要水的质量为x,
10g×98%=(10g+x)×19.6%,
x=40g,
答:需要水的质量是40g.
由表中数据可知,前四次中每次生成氢气的质量是0.02g,因此m=0.06;
设锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 2
y 0.08g
$\frac{65}{y}$=$\frac{2}{0.08g}$,
y=2.6g,
此黄铜样品中锌的质量分数为:$\frac{2.6g}{8g}$×100%=32.5%,
故填:0.06;32.5%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
7.自然界里水的天然循环中没有涉及到的是( )
| A. | 水分子间的间隔 | B. | 水分子的运动 | C. | 水的化学变化 | D. | 水的物理变化 |
11.在化学反应A+B→C中,6g A跟足量的B反应,生成17g C,则参加反应的B的质量是( )
| A. | 5g | B. | 3g | C. | 8g | D. | 11g |
1.下列化肥属于复合肥料的是( )
| A. | 硝酸钾 | B. | 氯化钾 | C. | 碳酸氢钠 | D. | 氨水(NH3•H2O) |
5.如图是水分子在一定条件下分解的示意图,从中获得的信息正确的是( )


| A. | 在化学反应中原子的数目一定不变 | |
| B. | 在化学反应中元素的化合价一定不变 | |
| C. | 在化学反应中分子的种类一定不变 | |
| D. | 水的质量与生成氢气和氧气的总质量相等 |
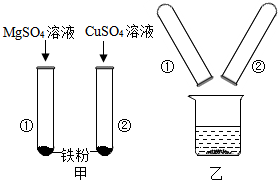 某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验.将实验甲反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.下列对滤液溶质可能的组成判断正确的是B(填字母序号)
某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验.将实验甲反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.下列对滤液溶质可能的组成判断正确的是B(填字母序号)
