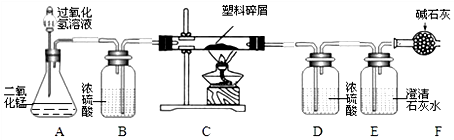
题目内容
12.某品牌纯碱中含有少量氯化钠.某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验:实验装置(如图2所示,固定装置略去):
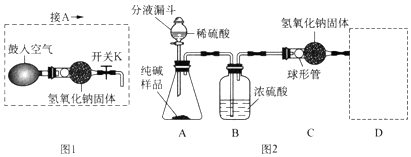
需要测定的实验数据:纯碱样品的质量;实验前后C装置(包含氢氧化钠固体)的质量.
(1)A装置中反应的化学方程式是Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;为了保证纯碱样品中的碳酸钠
完全反应,其操作是加入足量稀硫酸.
(2)B装置的作用是吸收二氧化碳中的水蒸气;C装置中反应的化学方程式是2NaOH+CO2═Na2CO3+H2O.
(3)补充D装置连接一个和C装置完全相同的装置 (简要叙述).
(4)为了克服图2装置的不足,有同学提出,还应增加图1装置与A装置连接(A装置中原
双孔橡胶塞换成三孔橡胶塞),在反应前、后用图1装置分两次缓缓鼓入空气.
①反应前,断开B、C装置之间的连接,用图1装置鼓入空气的作用是排出装置中的二氧化碳气体.
②反应后,用图1装置鼓入空气的作用是使反应生成的二氧化碳全部被C装置吸收.
(5)称得纯碱样品的质量为10.8g,实验前、后C装置的总质量分别为75.2g和79.6g,纯碱的纯度为98.1%(计算结果保留小数点后1位).
(6)某同学采用滴加足量Ba(OH)2溶液,生成BaC03沉淀,过滤、洗涤、干燥,称量BaCO3质量,最终测得纯碱纯度为104%,假设原碳酸钠样品中可能含有的杂质有NaCl、NaHCO3.则可能的原因是B.(填字母.已知:NaHCO3+Ba(OH)2═BaCO3↓+NaOH+H2O)
A.样品中一定含有NaCl
B.样品中一定含有NaHCO3
C.样品中可能含有NaHCO3.
分析 (1)碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳;
(2)浓硫酸能够吸收水蒸气,二氧化碳和氢氧化钠反应生成碳酸钠和水;
(3)空气中含有水蒸气和二氧化碳;
(4)空气通过氢氧化钠后,二氧化碳能被氢氧化钠吸收;
(5)根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断;
(6)根据反应的化学方程式及其质量关系可以进行相关方面的判断.
解答 解:(1)A装置中碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式是:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
为了保证纯碱样品中的碳酸钠完全反应,其操作是加入足量稀硫酸.
故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;加入足量稀硫酸.
(2)B装置的作用是吸收二氧化碳中的水蒸气;
C装置中二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O.
故填:吸收二氧化碳中的水蒸气;2NaOH+CO2═Na2CO3+H2O.
(3)补充的D装置是连接一个和C装置完全相同的装置,以防空气中的二氧化碳和水蒸气进入C装置,影响实验结果.
故填:连接一个和C装置完全相同的装置.
(4)①反应前,断开B、C装置之间的连接,用图1装置鼓入空气的作用是排出装置中的二氧化碳气体.
故填:排出装置中的二氧化碳气体.
②反应后,用图1装置鼓入空气的作用是使反应生成的二氧化碳全部被C装置吸收.
故填:使反应生成的二氧化碳全部被C装置吸收.
(5)设碳酸钠质量为x,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x 79.6g-75.2g
$\frac{106}{x}$=$\frac{44}{79.6g-75.2g}$,
x=10.6g,
纯碱的纯度为:$\frac{10.6g}{10.8g}$×100%=98.1%,
故填:98.1.
(6)碳酸钠、碳酸氢钠和氢氧化钡反应的化学方程式及其质量关系为:
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,
106 197
NaHCO3+Ba(OH)2═BaCO3↓+NaOH+H2O,
84 197
由以上质量关系可知,相同质量的碳酸钠、碳酸氢钠和氢氧化钡反应时,碳酸氢钠和氢氧化钡反应生成的碳酸钡质量大,最终测得纯碱纯度为104%,说明
样品中一定含有碳酸氢钠.
故填:B.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 干电池对外供电 | B. | 酒精挥发 | ||
| C. | 夏季剩饭剩菜腐败变质 | D. | 擦燃火柴 |

| A. | 10℃时,将30 g A物质放入50 g水中充分搅拌后所得溶液的质量为80 g | |
| B. | 将30℃时,A、B、C三种物质的饱和溶液降温到10℃,C的溶质质量分数保持不变 | |
| C. | 升高温度可以使C的不饱和溶液转变成饱和溶液 | |
| D. | 采用冷却热饱和溶液的方法可以从A、B的混合物中分离A物质 |
| A. | 燃烧都伴着发光、放热,所以有发光、放热现象的就是燃烧 | |
| B. | NaCl溶于水时溶液温度无明显变化,所以NH4NO3溶于水时溶液温度也无明显变化 | |
| C. | 因为0℃的冰和0℃的水的温度相同,所以在冷却食品时,它们的冷却效果是相同的 | |
| D. | 中和反应有盐和水生成,有盐和水生成的反应不一定是中和反应 |
 如图为某医用生理盐水注射液的标签中的部分内容,计算:
如图为某医用生理盐水注射液的标签中的部分内容,计算: