题目内容
7.由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题.某化学研究小组的同学对某种塑料袋的组成进行分析研究,测定样品中元素的质量比,设计了如图所示的实验装置.( 小资料:该塑料只含C、H 两种元素,燃烧产物为二氧化碳和水.图中碱石灰可以吸收空气中的水蒸气和二氧化碳)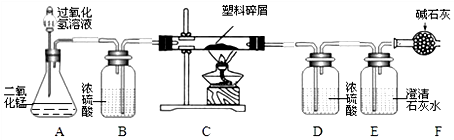
(1)按上面连接好装置,在装入药品之前,必须进行的操作是检查装置气密性.
(2)装置E 中反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
(3)判断塑料袋试样中含有碳元素的依据是E装置中澄清石灰水变浑浊.装置F 的作用是防止空气中的二氧化碳进入E中使测量结果不准确.
(4)根据实验前后装置的质量变化测算出仪器D质量增重5.4g,仪器 E 质量增重 8.8g,则该塑料袋试样中氢元素的质量为0.6g.
(5)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果偏大( 填“偏小”、“偏大”或“无影响”)
分析 (1)按上面连接好装置,在装入药品之前,必须检查装置气密性;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水;
(3)塑料袋试样中含有碳元素和氢元素,完全燃烧生成水和二氧化碳,水能被浓硫酸吸收,二氧化碳能使澄清石灰水变浑浊;
(4)塑料袋试样中的氢元素完全燃烧后全部转化到水中,水中的氢元素质量即为塑料袋试样中氢元素的质量;
(5)若装置中没有连接装置B,将使测定生成的水的质量偏大,从而导致该塑料试样中氢元素的质量测算结果偏大.
解答 解:(1)按上面连接好装置,在装入药品之前,必须进行的操作是检查装置气密性.
故填:检查装置气密性.
(2)装置E中,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:Ca(OH)2+CO2═CaCO3↓+H2O.
(3)判断塑料袋试样中含有碳元素的依据是E装置中澄清石灰水变浑浊,这是因为澄清石灰水变浑浊,说明反应生成了二氧化碳,进一步说明样品中含有碳元素;
装置F的作用是:防止空气中的二氧化碳进入E中使测量结果不准确.
故填:E装置中澄清石灰水变浑浊;防止空气中的二氧化碳进入E中使测量结果不准确.
(4)该塑料袋试样中氢元素的质量为:5.4g×$\frac{2}{18}$×100%=0.6g,
故填:0.6g.
(5)若装置中没有连接装置B,将使测定生成的水的质量偏大,从而导致该塑料试样中氢元素的质量测算结果偏大.
故填:偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
16.如图所示的实验操作中正确的是( )
| A. |  使用测电笔 | B. |  测量物体的长度 | C. |  测定溶液的pH | D. |  测液体的温度 |
17.下列物质的用途仅利用了其化学性质的是( )
| A. | 生活中用镶有金刚石的玻璃刀裁划玻璃 | |
| B. | 常温下的超导体可广泛用于输电导线 | |
| C. | 农业上常用熟石灰改良酸性土壤 | |
| D. | 液态二氧化碳灭火器用于扑灭图书、档案的失火 |
14.如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )


| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 甲中含有少量的乙,可以用蒸发溶剂的方法提纯乙 | |
| C. | t2℃时,将甲和乙两种物质的溶液分别降温到t1℃,析出晶体的质量甲一定大于乙 | |
| D. | t2℃时,乙饱和溶液中溶质的质量分数一定小于甲饱和溶液中溶质的质量分数 |
16.下列实验操作错误的是( )
| A. |  | B. |  | C. |  | D. |  |
17.向含有AgNO3和Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤.向滤渣中滴加稀盐酸,没有气体生成.下列结论正确的是( )
| A. | 滤液中一定有Zn2+和Cu2+ | |
| B. | 滤液中一定有Zn2+,可能有Cu2+和Ag+ | |
| C. | 滤渣中一定有Cu | |
| D. | 滤渣中一定是Cu和Ag的混合物 |