题目内容
7.维生素C又名抗坏血酸,其化学式为C6H8O6,易溶于水,易被氧化,能与碘反应,人体缺乏维生素C可能引发多种疾病,某研究性学习小组对它研究如下:(1)猜想:维生素C可能具有酸性
(2)实验方案:
提供试剂:
维生素C片、蒸馏水、紫色石蕊溶液、无色酚酞溶液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸.
根据以上试剂,请你帮助他们设计两种方案,并写出实验现象:
| 实 验 内 容 | 实 验 现 象 |
| 方案Ⅰ维生素C片溶于蒸馏水配成溶液,向其中滴加紫色石蕊溶液 | 溶液变红色 |
| 方案Ⅱ维生素C片溶于蒸馏水配成溶液,用玻璃棒蘸取该溶液滴在pH试纸上,稍后读数 | pH小于7 |
A.金属铜 B.食盐 C.氢氧化钠 D.硫酸铜.
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响.他设计了如下实验方案:
Ⅰ.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ.取两支盛有2mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
| 汁液 | 新鲜西红柿的汁液 | 放置一周的西红柿的汁液 |
| 滴数 | 12 | 20 |
①你认为西红柿中维生素C含量高的是新鲜的西红柿.
②你从中得到的启示是西红柿等蔬菜、水果中含有的维生素C,随着放置时间的增长含量会减少.因此,我们要尽量吃新鲜的蔬菜、水果.
分析 (2)根据酸的化学性质和酸溶液的鉴定方法回答,根据酸的化学性质,检验酸溶液时一般用指示剂,如紫色的石蕊溶液,还能用pH试纸测定溶液的pH值.
(3)酸能与某些活泼金属、碱、某些盐以及金属氧化物发生化学反应;
(4)根据新鲜西红柿和放置一周的西红柿汁液使蓝色碘的淀粉溶液褪色的用量,可以判断维生素C的含量高低.
解答 解:由酸的化学性质,检验酸溶液时一般用指示剂,如紫色的石蕊溶液,还能用pH试纸测定溶液的pH值,故答案为:
| 实验方案 | 实验现象 |
| 维生素C片溶于蒸馏水配成溶液,向其中滴加紫色石蕊溶液. | 溶液变红色 |
| 维生素C片溶于蒸馏水配成溶液,用玻璃棒蘸取该溶液滴在pH试纸上,稍后读数 | pH小于7 |
(4)根据实验可以看出,使蓝色碘的淀粉溶液褪色,需要新鲜的西红柿汁液量少,需要放置一周的西红柿的汁液量多,所以新鲜西红柿中维生素花C的含量高,由此可知维生素C的含量随着放置时间的增长会减少,所以答案为:①新鲜的西红柿;②西红柿等蔬菜、水果中含有的维生素C,随着放置时间的增长含量会减少.因此,我们要尽量吃新鲜的蔬菜、水果
故答案为:(2)
| 实 验 内 容 | 实 验 现 象 |
| 方案Ⅰ维生素C片溶于蒸馏水配成溶液,向其中滴加紫色石蕊溶液 | 溶液变红色 |
| 方案Ⅱ维生素C片溶于蒸馏水配成溶液,用玻璃棒蘸取该溶液滴在pH试纸上,稍后读数 | pH小于7 |
②西红柿等蔬菜、水果中含有的维生素C,随着放置时间的增长含量会减少.因此,我们要尽量吃新鲜的蔬菜、水果.
点评 化学实验方案的设计是素质教育的基本要求,是考查学生能力的主要题目类型,同时也是实验教与学难点所在,在具体设计时,要充分利用教材资源,对其原理透彻理解,学会信息迁移,既要模仿,又要注重创新.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列图象不能正确反映对应变化关系的是( )
| A. |  稀释10%NaOH和10% H2SO4 | |
| B. |  向相等质量锌粉和铁粉中分别加入相同的稀盐酸 | |
| C. |  将水通电电解一段时间 | |
| D. |  加热一定量高锰酸钾固体 |
2.学校研究性学习小组选择探究“CuSO4溶液显蓝色与什么离子有关?”作为研究课题,以下是他们提交的实验方案,其中不需要做的实验是( )
| A. | 观察Na2SO4、K2SO4溶液的颜色 | |
| B. | 观察HNO3、Cu(NO3)2溶液的颜色 | |
| C. | 向CuSO4溶液中滴加适量的NaOH溶液,静置后观察溶液颜色 | |
| D. | 加水稀释后观察溶液的颜色 |
19.在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.于是对其成分进行科学探究,请你一起完成探究的过程.
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因CO2+2NaOH═Na2CO3+H2O.
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图1所示实验.

甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠.
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中溶液变红,B试管出现大量气泡,C试管中出现白色沉淀;C试管中现象产生的原因是(用化学方程式表示)Na2CO3+BaCl2=BaCO3↓+2NaCl.
(2)乙同学认为甲同学的结论是不正确的,原因是碳酸钠溶液呈碱性,也是无色酚酞变红.
【实验设计】请你设计合理的实验方案,填入下列表格中.
Ⅱ固体中各成分含量
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图2(I)所示实验.
(1)在量气管内水面上架一薄层油,目的是防止二氧化碳溶于水;将Y形管(装置A)向左倾斜,硫酸流到样品中.
(2)使样品与稀硫酸反应的操作为将Y形管(装置A)向左倾斜,硫酸流到样品中.
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4mL(已知该温度压强下,CO2的密度为1.965g/L),请你计算出样品中Na2CO3质量分数.(写出计算过程)
(4)小明同学设计如图2(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是逸出的二氧化碳中含有水蒸汽.
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因CO2+2NaOH═Na2CO3+H2O.
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图1所示实验.

甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠.
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中溶液变红,B试管出现大量气泡,C试管中出现白色沉淀;C试管中现象产生的原因是(用化学方程式表示)Na2CO3+BaCl2=BaCO3↓+2NaCl.
(2)乙同学认为甲同学的结论是不正确的,原因是碳酸钠溶液呈碱性,也是无色酚酞变红.
【实验设计】请你设计合理的实验方案,填入下列表格中.
| 操作 | 现象 | 结论 |
| 取少量结块固体于试管(或烧杯)中,加水使其完全溶解,加入过量的氯化钡或氯化钙溶液,静置后,向上层清液(或过滤后向滤液)中滴加几滴无色酚酞溶液 | 若溶液变红 | 固体为碳酸钠和氢氧化钠 |
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图2(I)所示实验.
(1)在量气管内水面上架一薄层油,目的是防止二氧化碳溶于水;将Y形管(装置A)向左倾斜,硫酸流到样品中.
(2)使样品与稀硫酸反应的操作为将Y形管(装置A)向左倾斜,硫酸流到样品中.
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4mL(已知该温度压强下,CO2的密度为1.965g/L),请你计算出样品中Na2CO3质量分数.(写出计算过程)
(4)小明同学设计如图2(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是逸出的二氧化碳中含有水蒸汽.
16.实验室中有久置的四瓶无色溶液,标签破损,只知道它们分别是稀硫酸、氢氧化钠溶液、碳酸钠溶液、氯化钠溶液.为鉴别它们,实验过程如下:
(1)甲同学取四中溶液少许于四支试管中,分别向其中滴加紫色石蕊试液,能鉴别出来的溶液是稀硫酸、氯化钠溶液.
(2)为鉴别剩余两种溶液,乙同学继续进行了以下实验设计.
(3)丙同学按照乙同学的方案进行实验,结果两支试管中都观察到了明显的现象,其可能的原因是氢氧化钠吸收空气中的二氧化碳生成了碳酸钠.
(4)实验结束后,同学们认为在实验室中使用和存放药品时应注意:①正确倾倒液体,保护好标签;②密封保存.
(1)甲同学取四中溶液少许于四支试管中,分别向其中滴加紫色石蕊试液,能鉴别出来的溶液是稀硫酸、氯化钠溶液.
(2)为鉴别剩余两种溶液,乙同学继续进行了以下实验设计.
| 实验操作 | 实验现象与化学方程式 |
| 分别取两溶液于两支试管中,分别向其中滴加稀盐酸. | 一支试管中有明显现象:有气体生成化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑. |
| 另一只试管中无明显现象 |
(4)实验结束后,同学们认为在实验室中使用和存放药品时应注意:①正确倾倒液体,保护好标签;②密封保存.
17.为了测定某生铁样品中铁的质量分数,某化学兴趣小组取生铁样品10g,将200g稀硫酸粉4次加入样品中,称得剩余固体的质量与所加稀硫酸的质量关系如下图所示:
(1)求生铁样品中铁的质量.
(2)计算所用稀硫酸的溶质质量分数.
| 所用稀硫酸的质量(g) | 50 | 50 | 50 | 50 |
| 剩余固体的质量(g) | 7.2 | 4.4 | 1.6 | 0.2 |
(2)计算所用稀硫酸的溶质质量分数.
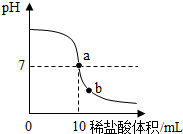 在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法:
在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法: 如图所示是镁原子的结构示意图,根据图示回答:镁原子在化学变化中容易失去(填“得到”或“失去”)电子,成为离子,镁离子的符号是Mg2+.
如图所示是镁原子的结构示意图,根据图示回答:镁原子在化学变化中容易失去(填“得到”或“失去”)电子,成为离子,镁离子的符号是Mg2+.