题目内容
1.小柯设计了如图1所示的实验装置,进行一氧化碳还原氧化铜的实验.试回答: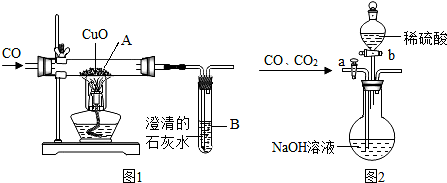
Ⅰ、(1)该装置的不足之处是缺少尾气的处理装置,而把一氧化碳直接排到空气中了.
(2)加热之前,先要进行的操作是先通入一氧化碳.
Ⅱ、为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞).
(3)利用该装置先分离出来的是一氧化碳气体.
(4)要想得到一氧化碳,小明应怎样操作?关闭活塞b,打开活塞a.
Ⅲ、对于A装置中反应后得到的红色固体(此时氧化铜已全部反应完),小明进行了以下探究.
【查阅资料】
①氧化铜经一氧化碳还原不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为Cu2O).
②Cu2O是不溶于水的红色固体,在酸性溶液中,可发生反应生成Cu2+和Cu.
【提出猜想】
氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O.
【进行实验】小明设计了一个最简单的实验方案.
| 实验步骤 | 取少量该红色固体放入盛有稀硫酸的试管中,振荡 |
| 实验现象及结论 | 若溶液变蓝,则含有氧化亚铜,若溶液颜色不变,则不含有氧化亚铜 |
分析 (1)根据一氧化碳有毒,扩散到空气中能够污染空气分析;
(2)根据一氧化碳和空气的混合气体受热时可能发生爆炸分析;
(3)根据要分离一氧化碳和二氧化碳的混合物,可以先使其中的二氧化碳转化为其他的物质,先得到一氧化碳解答
(4)根据要分离一氧化碳和二氧化碳的混合物,可以先使其中的二氧化碳转化为其他的物质,得到一氧化碳,然后再加入物质生成二氧化碳解答;
(5)根据氧化亚铜与铜的性质差别进行确定是否含有氧化亚铜解答.
解答 解:(1)由于一氧化碳有毒,直接排到空气中能够造成污染,应该对尾气处理;
(2)如果先给氧化铜加热,一氧化碳和空气的混合气体受热时可能发生爆炸.故先通入一氧化碳;
(3)关闭活塞b,打开活塞a时,通入的混合气体中的二氧化碳会与氢氧化钠反应生成碳酸钠,从而将二氧化碳除去,分离得到一氧化碳,所以本题答案为:一氧化碳;
(4)关闭活塞b,打开活塞a时,通入的混合气体中的二氧化碳会与氢氧化钠反应生成碳酸钠,从而将二氧化碳除去,分离得到一氧化碳;
(5)氧化亚铜能与硫酸反应生成蓝色的铜盐溶液,而铜不与硫酸反应;
故答为:
(1)缺少尾气的处理装置,而把一氧化碳直接排到空气中了;
(2)先通入一氧化碳;
(3)一氧化碳;
(4)关闭活塞b,打开活塞a;
(5)
| 实验步骤 | 取反应后固体置于试管中,加入足量的稀硫酸 |
| 实验现象及结论 | 若溶液变蓝,则含有氧化亚铜,若溶液颜色不变,则不含有氧化亚铜 |
点评 主要考查了一氧化碳的性质,一氧化碳还原氧化铜的实验.要掌握一氧化碳还原氧化铜的实验原理和实验中的一些注意事项.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
11.金属钠是一种易燃物品,不仅能在氧气中燃烧,而且能在二氧化碳中燃烧,因此当金属钠着火的时候不能使用二氧化碳灭火器,钠和二氧化碳反应的化学方程式为:4Na+3CO2 $\frac{\underline{\;点燃\;}}{\;}$ 2Na2CO3+C,该反应类型属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
12. 元素中期表中含有大量的化学知识点和信息,根据如图能直接得到的信息说法不正确的是( )
元素中期表中含有大量的化学知识点和信息,根据如图能直接得到的信息说法不正确的是( )
 元素中期表中含有大量的化学知识点和信息,根据如图能直接得到的信息说法不正确的是( )
元素中期表中含有大量的化学知识点和信息,根据如图能直接得到的信息说法不正确的是( )| A. | 钠原子最外层有11个电子 | B. | 钠的相对原子质量是22.99 | ||
| C. | 钠属于金属元素 | D. | 钠的原子序数为11 |
16.根据实验现象进行分析、推测是我们学习科学的基本方法.下列基于实验现象作出的分析推测不正确的是( )
| A. | 羊毛放在火焰上灼烧,能闻到焦羽毛味,说明羊毛中含有蛋白质 | |
| B. | 滚摆摆动时,上升高度越来越低,说明部分机械能转化为其他形式的能 | |
| C. | 滴加BaCl2溶液后有白色沉淀,则该溶液中一定有CO32- | |
| D. | 铁粉和硫磺混合加热后,磁铁靠近不能吸引生成物,说明发生了化学变化 |
6.“硫酸铜晶体中结晶水含量的测定”的实验步骤如下:
(a)研磨:在研钵中将硫酸铜晶体研碎.(防止加热时可能发生迸溅)
(b)称量:准确称量一干燥洁净的瓷坩锅质量.
(c)再称:称量瓷坩埚+硫酸铜晶体的质量.
(d)加热:小火缓慢加热至蓝色晶体全部变为白色粉末,并放入干燥器中冷却.
(e)再称:在干燥器内冷却后,称量瓷坩埚+硫酸铜粉末的质量.
(f)再加热:把盛有硫酸铜的瓷坩埚再加热,再冷却.
(g)再称量:将冷却后的盛有硫酸铜的瓷坩埚再次称量,并再次重复加热和称量步骤,直至两次称量误差小于0.1g为止.
(h)计算:根据实验测得的结果计算硫酸铜晶体中结晶水的质量分数.
请你请回答下列问题:
(1)实验中,需用到的实验仪器有:托盘天平、瓷坩埚、坩埚钳、铁三脚、石棉网、玻璃棒、干燥器、酒精灯、研钵、药匙(填两种).
(2)本实验过程中,最少应进行4次称量操作.
(3)判断硫酸铜晶体是否完全失水方法是最后一次加热前后两次质量数据差不超过0.1g.
(4)下面是高远同学所做的1次实验的数据,请你根据实验数据帮他完成计算,填入下面的表中.
(5)根据硫酸铜晶体的化学式,可以得出硫酸铜晶体中结晶水的含量应为36%.如果高远同学所做实验的结晶水质量分数偏高,其原因可能是B、C(选填字母).
A.硫酸铜晶体中含有不挥发性杂质
B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去
D.加热失水后露置在空气中冷却.
(a)研磨:在研钵中将硫酸铜晶体研碎.(防止加热时可能发生迸溅)
(b)称量:准确称量一干燥洁净的瓷坩锅质量.
(c)再称:称量瓷坩埚+硫酸铜晶体的质量.
(d)加热:小火缓慢加热至蓝色晶体全部变为白色粉末,并放入干燥器中冷却.
(e)再称:在干燥器内冷却后,称量瓷坩埚+硫酸铜粉末的质量.
(f)再加热:把盛有硫酸铜的瓷坩埚再加热,再冷却.
(g)再称量:将冷却后的盛有硫酸铜的瓷坩埚再次称量,并再次重复加热和称量步骤,直至两次称量误差小于0.1g为止.
(h)计算:根据实验测得的结果计算硫酸铜晶体中结晶水的质量分数.
请你请回答下列问题:
(1)实验中,需用到的实验仪器有:托盘天平、瓷坩埚、坩埚钳、铁三脚、石棉网、玻璃棒、干燥器、酒精灯、研钵、药匙(填两种).
(2)本实验过程中,最少应进行4次称量操作.
(3)判断硫酸铜晶体是否完全失水方法是最后一次加热前后两次质量数据差不超过0.1g.
(4)下面是高远同学所做的1次实验的数据,请你根据实验数据帮他完成计算,填入下面的表中.
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 晶体中结晶水质量分数 |
| 12.0g | 22.0g | 18.2g | 38% |
A.硫酸铜晶体中含有不挥发性杂质
B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去
D.加热失水后露置在空气中冷却.
13. 如图是验证氧气约占空气总体积$\frac{1}{5}$的实验装置图,下列有关说法正确的是( )
如图是验证氧气约占空气总体积$\frac{1}{5}$的实验装置图,下列有关说法正确的是( )
 如图是验证氧气约占空气总体积$\frac{1}{5}$的实验装置图,下列有关说法正确的是( )
如图是验证氧气约占空气总体积$\frac{1}{5}$的实验装置图,下列有关说法正确的是( )| A. | 本实验不需要检查装置气密性 | |
| B. | 燃烧匙内盛放过量的红磷使测量结果更准确 | |
| C. | 改用细铁丝在空气中燃烧也能测得相同的结果 | |
| D. | 为确保瓶中氧气全部参加反应,点燃红磷后应将燃烧匙慢慢伸入瓶中 |
10.同学们在做铁丝在氧气中燃烧实验时没有明显火星四射现象,导致现象不明显的原因可能是( )
| A. | 排水法收集氧气前未将集气瓶注满水 | |
| B. | 等导管口连续放出气泡就开始收集氧气 | |
| C. | 收集满氧气后盖上毛玻璃片拿出水面 | |
| D. | 未在集气瓶中预先放少量水或细沙 |
11.针对2013年12月中旬发生的杭州部分城区自来水异味事件,水样经多轮专家综合论证,基本认定引起此次异味的主要物质是邻叔丁基苯酚(化学式为C10H14O)沸点是224.1℃,易溶于丙酮、苯、甲醇等有机溶剂,微溶于水.以下说法中正确的是( )
| A. | 邻叔丁基苯酚的各元素质量比为10:14:1 | |
| B. | 邻叔丁基苯酚是由许许多多的离子构成 | |
| C. | 邻叔丁基苯酚溶于酒精形成的酒精溶液进行蒸馏,先变成蒸气分离出来的是邻叔丁基苯酚 | |
| D. | 邻叔丁基苯酚中的碳元素的质量分数为80% |
