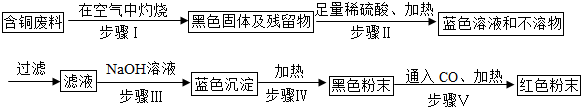
题目内容
9.在研究某大理石样品(杂质不溶于水也不与盐酸反应)的活动中,兴趣小组同学进行了如下实验,过程如图所示:
求:(1)反应生成二氧化碳的质量8.8g;
(2)参加反应的稀盐酸中溶质HCl的质量;
(3)该大理石样品中碳酸钙的质量分数.(根据化学方程式计算)
分析 (1)根据质量守恒定律计算生成二氧化碳的质量;
(2)根据碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量和参加反应的盐酸的质量,即可求出大理石中碳酸钙的质量分数.
解答 解:(1)反应生成二氧化碳的质量是:100g+25g-116.2g=8.8g;
(2)设大理石样品中碳酸钙的质量为x,参加反应的盐酸的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 8.8g
$\frac{100}{x}$=$\frac{73}{y}$=$\frac{44}{8.8g}$=
x=20g
y=14.6g
所以参加反应的稀盐酸中溶质HCl的质量是14.6g;
(3)大理石样品中碳酸钙的质量分数为:$\frac{20g}{25g}$×100%=80%.
故答案为:(1)8.8g;
(2)14.6g;
(3)80%.
点评 根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算,有关反应前后质量减少的计算是初中化学计算的一个常见内容,一般的规律是依据质量的变化求出某一生成的质量.

练习册系列答案
相关题目
19.关于饮酒带来的危害逐年增加,股骨头坏死,肝硬化等疾病更是使很多人苦不堪言,关于酒的主要成分乙醇(C2H5OH)下列说法正确的是( )
| A. | 乙醇由三种元素组成,属于混合物 | B. | 乙醇的相对分子质量是45 | ||
| C. | 乙醇中碳氢质量比为4:1 | D. | 一个乙醇分子中含有三个氢分子 |
20.下列根据现象所作出的推测,符合事实的是( )
| A. | 在某固体物质中加入稀盐酸,产生大量气泡$\stackrel{推测}{→}$该物质一定是碳酸盐 | |
| B. | 芝麻和黄豆混合前总体积大于混合后体积$\stackrel{推测}{→}$构成物质的分子之间存在着空隙 | |
| C. | 轻质带电小球A放在另一个轻质小球B旁受力偏转$\stackrel{推测}{→}$B球与A球带异种电荷 | |
| D. | 将干冷的烧杯罩在蜡烛的火焰上方,内壁出现小水珠$\stackrel{推测}{→}$蜡烛中含有氢元素 |
14.下列实验操作不正确的是( )
| A. |  熄灭酒精灯 | B. |  闻气味 | C. |  制作血涂片 | D. |  滴加试液 |
1.小柯设计了如图1所示的实验装置,进行一氧化碳还原氧化铜的实验.试回答:
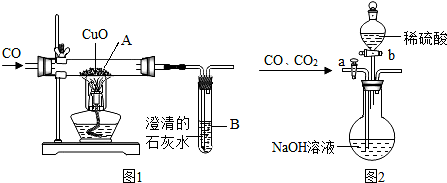
Ⅰ、(1)该装置的不足之处是缺少尾气的处理装置,而把一氧化碳直接排到空气中了.
(2)加热之前,先要进行的操作是先通入一氧化碳.
Ⅱ、为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞).
(3)利用该装置先分离出来的是一氧化碳气体.
(4)要想得到一氧化碳,小明应怎样操作?关闭活塞b,打开活塞a.
Ⅲ、对于A装置中反应后得到的红色固体(此时氧化铜已全部反应完),小明进行了以下探究.
【查阅资料】
①氧化铜经一氧化碳还原不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为Cu2O).
②Cu2O是不溶于水的红色固体,在酸性溶液中,可发生反应生成Cu2+和Cu.
【提出猜想】
氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O.
【进行实验】小明设计了一个最简单的实验方案.

Ⅰ、(1)该装置的不足之处是缺少尾气的处理装置,而把一氧化碳直接排到空气中了.
(2)加热之前,先要进行的操作是先通入一氧化碳.
Ⅱ、为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞).
(3)利用该装置先分离出来的是一氧化碳气体.
(4)要想得到一氧化碳,小明应怎样操作?关闭活塞b,打开活塞a.
Ⅲ、对于A装置中反应后得到的红色固体(此时氧化铜已全部反应完),小明进行了以下探究.
【查阅资料】
①氧化铜经一氧化碳还原不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为Cu2O).
②Cu2O是不溶于水的红色固体,在酸性溶液中,可发生反应生成Cu2+和Cu.
【提出猜想】
氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O.
【进行实验】小明设计了一个最简单的实验方案.
| 实验步骤 | 取少量该红色固体放入盛有稀硫酸的试管中,振荡 |
| 实验现象及结论 | 若溶液变蓝,则含有氧化亚铜,若溶液颜色不变,则不含有氧化亚铜 |
19.氢氧化铜、氢氧化铁、氢氧化锌的混合物若干,与10%的硫酸溶液完全反应,生成3.6g的水,则已反应的稀硫酸的质量为( )
| A. | 196g | B. | 49g | C. | 100g | D. | 98g |
 如图,一辆载满电石的货车在雨中行驶时突然燃起大火,并伴有大量黑烟.某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动.
如图,一辆载满电石的货车在雨中行驶时突然燃起大火,并伴有大量黑烟.某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动.