题目内容
18.某化学兴趣小组利用图1装置探究制取气体的原理、方法及性质.结合装置图,回答下列问题: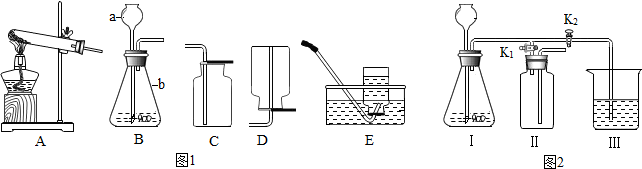
(1)写出仪器的名称a.长颈漏斗,b.锥形瓶.收集某气体只能用D装置,由此推测该气体具有的性质是密度比空气小、能溶于水.
(2)用大理石和稀盐酸制取二氧化碳时,可选用的发生与收集装置是B和C(选填图1字母,上同),化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(3)该小组设计了如图2所示的实验装置,既可用于制取气体,又可用于探究物质性质.
①当打开K1、关闭K2时,利用装置Ⅰ、Ⅱ,可进行的实验是b(选填字母).
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用装置Ⅰ、Ⅲ制得二氧化碳并验证其性质.为了进一步验证产生的气体是二氧化碳,该同学将气体通入装置Ⅲ中,则该装置中应加入的试剂为Ca(OH)2(填化学式).若在装置Ⅲ中加入紫色石蕊试液,观察到的现象是紫色石蕊试液变成红色.得出的结论是:CO2+H2O═H2CO3(用化学方程式表达).
分析 (1)熟记常见仪器的名称和决定收集方法的因素;
(2)根据反应物的状态和反应条件来选制取装置,根据气体的性质来选收集方法;
(3)①根据发生装置和收集方法的特点分析;②根据二氧化碳能与水发生反应产生碳酸,显酸性回答.
解答 解:(1)a 是长颈漏斗,b 是锥形瓶,气体只能用向下排空气法来收集,说明该气体密度比空气大、能溶于水;故填:长颈漏斗;锥形瓶;密度比空气大;能溶于水;
(2)大理石是固体,盐酸是液体,反应是在常温下进行的,故选B来制取,二氧化碳的密度比空气大,能溶于水,故用向上排空气法来收集;故填:B;C;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)①当打开K1、关闭K2时,利用I、Ⅱ装置,可制取的气体是固液常温型的气体制取及该气体的密度比空气小;锌与稀硫酸反应制取氢气的发生装置特点属于固液常温型,且氢气的密度比空气小,故选择b;
②检验二氧化碳用澄清的石灰水,二氧化碳能与水反应生成碳酸,碳酸能使紫色的石蕊试液变红色.
故填:①b;②Ca(OH)2;紫色石蕊变成红色;CO2+H2O=H2CO3.
故答案为:
(1)长颈漏斗;锥形瓶;密度比空气小;能溶于水;
(2)大理石(或石灰石);B;C;CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)①b;②Ca(OH)2;紫色石蕊试液变成红色;CO2+H2O═H2CO3.
点评 本题考查了实验室制取气体的发生装置、收集方法的选择以及气体的性质检验,可依据气体发生装置、收集方法的依据及气体的性质逐一分析.

练习册系列答案
相关题目
8.下列符号中,表示两个氢原子的是( )
| A. | H2 | B. | 2H2 | C. | 2H+ | D. | 2H |
9.将5.6g铁粉加入到100g硫酸铜溶液中,恰好完全反应,则反应后所得溶液中溶质的质量分数为( )
| A. | 15.3% | B. | 32.4% | C. | 49.3% | D. | 52.6% |
6.用“ ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如图:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如图:

下列说法正确的是( )
 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如图:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如图:
下列说法正确的是( )
| A. | 化学反应的实质是原子的重新组合 | |
| B. | 该反应是置换反应 | |
| C. | 参加反应的A2与B2的分子个数比为2:1 | |
| D. | 该反应前后元素的化合价不变 |
13.某无色气体可能含有氢气、一氧化碳、二氧化碳、水蒸气中的一种或几种,某兴趣小组同学利用图中的实验装置设计实验,探究混合气体的组成,下列说法正确的是( )


| A. | 若检验混合气体中是否存在水蒸气,可将混合气体通入装置④ | |
| B. | 若检验混合气体中是否存在一氧化碳,可将混合气体依次通过装置⑤① | |
| C. | 将混合气体依次通过装置①②,可以检验并除去混合气体中的二氧化碳 | |
| D. | 探究混合气体中各成分的装置组合为:④①②③⑤①④ |
3.某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验.取废水200g,向其中加入溶质质量分数为20%的氢氧化钠溶液.测得生成沉淀的质量与所加入的氢氧化钠溶液的质量关系如表:
根据所得数据分析和计算:
(1)向200g该废水中加入足量的氢氧化钠溶液产生沉淀的质量为19.6g.
(2)求200g该废水中硫酸铜的溶质质量分数.
(3)200g该废水中硫酸的溶质质量为9.8g.
(4)另取同样的200g该废水,向其中加入17.1%的Ba(OH)2溶液.请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图.
| 加入的氢氧化钠溶液的质量/g | 40 | 80 | 120 | 160 |
| 生成沉淀的质量/g | 0 | 9.8 | 19.6 | 19.6 |
(1)向200g该废水中加入足量的氢氧化钠溶液产生沉淀的质量为19.6g.
(2)求200g该废水中硫酸铜的溶质质量分数.
(3)200g该废水中硫酸的溶质质量为9.8g.
(4)另取同样的200g该废水,向其中加入17.1%的Ba(OH)2溶液.请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图.

7.2014年12月23日,湘南商品交易中心首个湘外交易品种--绿茶(日照)挂牌上市.绿茶中含有单宁酸(C76H52O46)具有抑制血压上升、清热解毒等功效.下列有关单宁酸的叙述不正确的是( )
| A. | 属于有机物 | |
| B. | 一个单宁酸分子中碳、氢、氧的原子个数比为38:26:23 | |
| C. | 由76个碳原子、52个氢原子和46个氧原子构成 | |
| D. | 与甲烷完全燃烧后的产物相同 |
8.鱼肝油、猪肝、菠菜中的维生素A都很丰富,维生素A(C20H30O)能维持人体正常的视觉反应,下列说法正确的是( )
| A. | 维生素A由C、H和O原子构成 | |
| B. | 维生素A中C、H、O的质量比为20:30:1 | |
| C. | 维生素A中氧元素的质量分数最小 | |
| D. | 维生素A是有机高分子化合物 |
 A~F是初中化学常见的物质,它们存在如图所示的关系(“一”表示两物质间能反应,“→”表示一种物质转化成另一种物质.部分生成物和反应条件已略去).A、B、C三种物质中都含有碳元素,A为黑色固体;D、E、F三种物质中都含有钙元素,F可作干燥剂.请回答下列问题:
A~F是初中化学常见的物质,它们存在如图所示的关系(“一”表示两物质间能反应,“→”表示一种物质转化成另一种物质.部分生成物和反应条件已略去).A、B、C三种物质中都含有碳元素,A为黑色固体;D、E、F三种物质中都含有钙元素,F可作干燥剂.请回答下列问题: