题目内容
3.某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验.取废水200g,向其中加入溶质质量分数为20%的氢氧化钠溶液.测得生成沉淀的质量与所加入的氢氧化钠溶液的质量关系如表:| 加入的氢氧化钠溶液的质量/g | 40 | 80 | 120 | 160 |
| 生成沉淀的质量/g | 0 | 9.8 | 19.6 | 19.6 |
(1)向200g该废水中加入足量的氢氧化钠溶液产生沉淀的质量为19.6g.
(2)求200g该废水中硫酸铜的溶质质量分数.
(3)200g该废水中硫酸的溶质质量为9.8g.
(4)另取同样的200g该废水,向其中加入17.1%的Ba(OH)2溶液.请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图.
分析 (1)根据表中数据分析产生沉淀的质量;
(2)根据氢氧化铜的质量结合方程式求解硫酸铜的质量,进一步计算废水中硫酸铜的溶质质量分数;
(3)由表中数据可知每40g氢氧化钠溶液与硫酸铜反应生成沉淀9.8g,所以前40g氢氧化钠溶液与硫酸反应,根据氢氧化钠的质量计算硫酸的质量;
(4)分别计算硫酸与Ba(OH)2溶液恰好反应的沉淀质量和所用Ba(OH)2溶液质量以及硫酸铜与Ba(OH)2溶液恰好反应的沉淀质量和所用Ba(OH)2溶液质量,描点连线.
解答 解:(1)根据表中数据分析产生沉淀的质量为19.6g;
(2)设200g废水中CuSO4的质量为x
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 98
x 19.6 g
$\frac{160}{x}$=$\frac{98}{19.6g}$
x=32 g
废水中硫酸铜的溶质质量分数为$\frac{32g}{200g}$×100%=16%;
答:废水中硫酸铜的溶质质量分数为16%.
(3)由表中数据可知每40g氢氧化钠溶液与硫酸铜反应生成沉淀9.8g,所以前40g氢氧化钠溶液与硫酸反应.
设废水中硫酸的质量为y
H2SO4+2NaOH=Na2SO4+2H2O
98 80
y 40g×20%
$\frac{98}{y}$=$\frac{80}{40g×20%}$
y=9.8g
答:废水中硫酸的质量为9.8g;
(4)设废液中硫酸与Ba(OH)2溶液恰好反应的硫酸钡质量为n,所用Ba(OH)2溶液质量m
H2SO4+Ba(OH)2═BaSO4↓+2H2O
98 171 233
9.8 g m×17.1% n
$\frac{98}{9.8g}$=$\frac{171}{m×17.1%}$=$\frac{233}{n}$
m=100g
n=23.3g
设废液中硫酸铜与Ba(OH)2溶液恰好反应的硫酸钡质量为a,氢氧化铜质量为b,所用Ba(OH)2溶液质量为c.
CuSO4+Ba(OH)2═BaSO4↓+Cu(OH)2↓
160 171 233 98
32 g c×17.1% a b
$\frac{160}{32g}$=$\frac{171}{c×17.1%}$=$\frac{233}{a}$=$\frac{98}{b}$
a=46.6g,
b=19.6g,
c=200g
氢氧化钡与废液中的硫酸和硫酸铜反应完全时,生成沉淀为
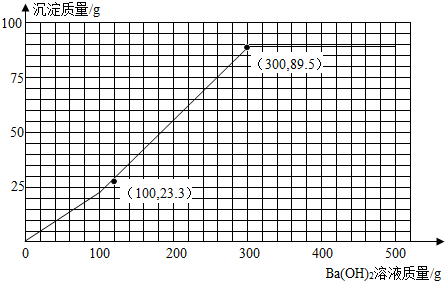
23.3 g+46.6 g+19.6 g=89.5 g
消耗Ba(OH)2溶液质量为100 g+200 g=300 g
所以加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图为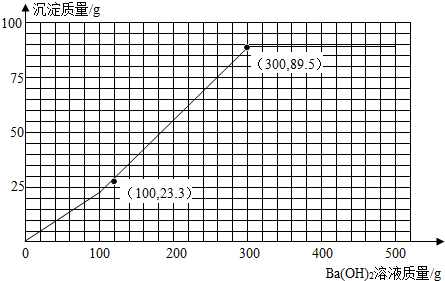
故答案为:(1)19.6g;
(2)16%;
(3)9.8g;
(4)
点评 本题是一道综合性很强的根据化学方程式计算,只要找准已知量和相应未知量是解答此类题目的关键所在,关于作图要找准起始点和折点即可.

| A. | 炒菜时油锅着火,立即用锅盖盖灭 | B. | 用水可以溶解食盐、白糖、油脂等 | ||
| C. | 用煮沸的方法可以使硬水软化 | D. | 用活性炭可去除冰箱里的异味 |

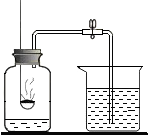 如图是初中化学的一个常见实验,该实验的目的是空气中氧气含量的测定,如果取用红磷的量偏多,则实际测得的实验结果将不变(填“偏大”、“偏小”或“不变”).
如图是初中化学的一个常见实验,该实验的目的是空气中氧气含量的测定,如果取用红磷的量偏多,则实际测得的实验结果将不变(填“偏大”、“偏小”或“不变”).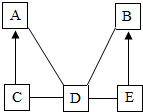 A、B、C、D、E是初中化学中常见的不同类别的物质,已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去),回答下列问题:
A、B、C、D、E是初中化学中常见的不同类别的物质,已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去),回答下列问题: