题目内容
9.将一定量铝粉和氧化铜混合加热,反应的化学方程式为:3CuO+2Al$\frac{\underline{\;加热\;}}{\;}$3Cu+A12O3 反应结束后,加入足量稀硫酸,充分反应后,将铁片插入溶液中.下列叙述的现象中,能够说明氧化铜没有完全反应的是( )①加入稀硫酸后,有气泡生成; ②加入稀硫酸后,没有气泡生成; ③加入稀硫酸后,
溶液中有红色不溶物质; ④插入溶液中的铁片表面有红色物质析出.
| A. | 只有④ | B. | ②③ | C. | ③④ | D. | ①③④ |
分析 要说明氧化铜没有完全反应,即是要通过实验来证明混合物中还有氧化铜.加入足量稀硫酸,再插入铁片,仍有氧化铜则可以看到铁片的表面会有红色固体析出.
解答 解:①如果氧化铜有剩余,加热反应充分反应后固体剩余物中不会含铝粉,加入稀硫酸时不会观察到有气泡放出;若有气泡生成,只能说明氧化铜不足,铝粉没有完全反应,故不符合题意;
②如果氧化铜有剩余,加热反应充分反应后固体剩余物中不会含铝粉,加入稀硫酸时不会观察到有气泡放出;但加入足量稀硫酸没有气泡也不能一定说明氧化铜有剩余,也可能是铝粉与氧化铜恰好完全反应,故不符合题意;
③铝粉与氧化铜混合加热后会能生成铜和氧化铝.反应后的固体中一定有铜和氧化铝,也可能含有氧化铜或者是铝.往反应后的固体中加入足量的稀硫酸,铜不能与稀硫酸反应,故溶液中一定会有红色不溶物质,不能说明是否含有氧化铜,故不符合题意;
④如果氧化铜有剩余,取反应后固体加硫酸时,可与硫酸反应生成硫酸铜,插入的铁片表面会有红色物质生成,符合题意;
故选A.
点评 两物质发生反应时,充分反应后若有一种反应物剩余,则另一反应物一定完全反应;本题注重考查了学生对反应中各种情况的分析,培养了灵活分析解答问题的能力.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
20.下列化学反应及反应类型与如图所示的微观变化对应的是( )


| A. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 化合反应 | |
| B. | 2HI+Cl2═2HCl+I2 置换反应 | |
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2↑ 分解反应 | |
| D. | 2HCl+CuO═CuCl2+H2O 复分解反应 |
17.我国科学家屠呦呦因为创制新型抗疟疾药--青蒿素,荣获2015年诺贝尔医学或生理学奖.开始屠呦呦尝试用水作溶剂,用加热青蒿素水溶液的方法使其沸腾,从而去除水分以提取药物,但提取后的药效并不理想.她猜想:可能在高温情况下,药物被破坏掉了.对此,可采用的方法是( )
| A. | 用微火加热使溶液慢慢沸腾 | B. | 用旺火加热缩短沸腾的时间 | ||
| C. | 增大容器内的气压 | D. | 用酒精做溶剂,再加热提取青蒿素 |
4.下表列出了硝酸钾在不同温度下的溶解度.
(1)从上表你可以得到什么信息(写一条即可)?硝酸钾的溶解度随温度升高而增大
(2)某同学在20℃时进行了如下实验,得到相应的溶液①~⑤中,充分溶解形成不饱和溶液的是②③④.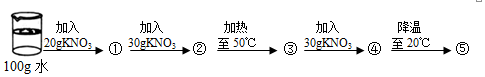
(3)20℃时,欲使一定量的硝酸钾饱和溶液变为不饱和溶液,可采取什么措施?增加溶剂(或升高温度)(任写一条)
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(2)某同学在20℃时进行了如下实验,得到相应的溶液①~⑤中,充分溶解形成不饱和溶液的是②③④.

(3)20℃时,欲使一定量的硝酸钾饱和溶液变为不饱和溶液,可采取什么措施?增加溶剂(或升高温度)(任写一条)
1.编制第一个元素周期表的科学家是( )
| A. | 道尔顿 | B. | 卢瑟福 | C. | 门捷列夫 | D. | 汤姆森 |
18.下列关于科学中“不同”的说法中正确的是( )
| A. | H2O与H2O2中氢元素的化合价不同 | |
| B. | O-16与O-18中氧原子的核外电子排布不同 | |
| C. | 镁原子与镁离子的化学性质不同 | |
| D. | 金刚石和石墨的性质差异较大的原因是碳原子的结构不同 |
19.通过对已学知识的对比和归纳,可以得出一些十分有趣的规律.这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读表中的内容,并回答相应的问题.
(1)由表格内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的电荷数相等;
(2)硫酸亚铁受热能分解,产物均为氧化物,唯一的固体产物呈红色,结合表中信息和反应原理,写出该分解反应产物的化学式:Fe2O3、SO2、SO3;.
| 常见元素或原子团 | OH- | SO42- | CO32- | H元素 | Na元素 | Cl元素 | Fe元素 | S元素 |
| 常见化合价 | -1 | -2 | -2 | +1 | +1 | -1、+5、+7 | +2、+3 | -2、+4、+6 |
(2)硫酸亚铁受热能分解,产物均为氧化物,唯一的固体产物呈红色,结合表中信息和反应原理,写出该分解反应产物的化学式:Fe2O3、SO2、SO3;.
