题目内容
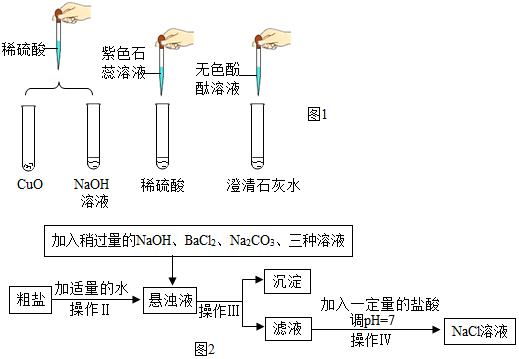
10. 某同学发现了标签部分破损且装有无色溶液的试剂瓶一个(如图),他们想指导内盛的是什么物质,因此,他们进行了如下探究
某同学发现了标签部分破损且装有无色溶液的试剂瓶一个(如图),他们想指导内盛的是什么物质,因此,他们进行了如下探究【提出问题】试剂瓶中盛的是什么物质?
【提出猜想】猜想Ⅰ:NaOH溶液;猜想Ⅱ:Na2CO3溶液;猜想Ⅲ:Na2SO4溶液;
猜想Ⅳ:NaCl溶液(再写一种猜想即可)
【设计实验】该小组为验证“猜想Ⅰ”、“猜想Ⅱ”是否正确,设计并完成如表所示实验
| 实验方案 | 实验一 | 实验二 | 实验三 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对照比色卡,pH>7 | 有无色无味气体产生 | 有白色沉淀产生 |
【实验与结论】实验全部完成后,正确的应是猜想Ⅱ.
【反思与评价】经过讨论,同学们认为“实验一”存在明显操作错误,该错误是pH试纸浸入待测液中,污染了待测液.
分析 【提出猜想】根据含钠物质的种类猜想该药品可能为什么物质;
【分析与推理】根据氢氧化钠和碳酸钠溶液酸碱度进行分析;
【实验与结论】根据碳酸钠的性质分析推断;>
【反思与评价】根据利用pH试纸测定溶液酸碱度的操作方法指出错误.
解答 解:【提出猜想】由于该试剂中含有钠元素,则若为碱,则为氢氧化钠;若为盐,则可为碳酸钠或是硫酸钠或氯化钠等;故填入:NaCl;
【分析与推理】由于氢氧化钠和碳酸钠溶液都显碱性,因此测得的pH>7,故无法判断是哪一种物质;
【实验与结论】由于碳酸钠溶液显碱性,能与稀盐酸反应生成了气体,能与氯化钡溶液反应生成了碳酸钡沉淀,所以实验全部完成后,正确的应是猜想Ⅱ.
【反思与评价】由图示可知“实验一”存在明显操作错误,该错误是:pH试纸浸入待测液中,污染了待测液.
故答为:(提出猜想】NaCl;
【分析与推理】NaOH溶液、Na2CO3溶液都显碱性,pH>7.
【实验与结论】Ⅱ.
【反思与评价】pH试纸浸入待测液中,污染了待测液.
点评 本题是缺失标签的实验探究题,相当于物质鉴别题,在鉴别几种物质时要从物质的不同性质入手,但试题涉及知识点多,要加强知识的全面性和系统性.特别注意检验溶液是否是氢氧化钠溶液,就需要排除碳酸钠对氢氧化钠的鉴定干扰,加入足量的氯化钙溶液可使碳酸根转化成沉淀,而后对溶液用酚酞试液进行检验,只要溶液此时变红,则可证明氢氧化钠的存在.

练习册系列答案
相关题目
20.下列潮湿的气体不能用固体氢氧化钠干燥的是( )
| A. | CO2 | B. | H2 | C. | CO | D. | O2 |
18.在学习中要不断总结,归纳发现规律,就能不断提高自己的能力.在标准状况下各气体相对分子质量、密度和实验室收集方法如下表,通过比较找出规律:
(1)从“相对分子质量”和“标况下密度”两列,可归纳出:一般来说,气体相对分子质量越大,标准状况下的密度越大;
(2)密度大于空气的气体可采用向上排空气法收集.
(3)实验室制取的氨气(化学式为NH3),可推测知密度比空气小,可用向下排空气法收集(氨气极易溶于水).
| 气体 | 相对分子质量 | 标况下密度(g/L) | 收集方法 |
| 空气 | 29 | 1.293 | 排水集气法 |
| 氧气 | 32 | 1.429 | 向上排空气法 |
| 二氧化碳 | 44 | 1.964 | 向上排空气法 |
| 氢气 | 2 | 0.089 | 向下排空气法 |
(2)密度大于空气的气体可采用向上排空气法收集.
(3)实验室制取的氨气(化学式为NH3),可推测知密度比空气小,可用向下排空气法收集(氨气极易溶于水).
15.如图中的符号表示2个氧分子的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列选项中属于模型的是( )
| A. |  | B. |  | C. | S=VT | D. |  |
 小李用甲图气体发生装置制取二氧化碳,老师给他提供了石灰石、无标签的稀盐酸和氯化钠水溶液各一瓶.
小李用甲图气体发生装置制取二氧化碳,老师给他提供了石灰石、无标签的稀盐酸和氯化钠水溶液各一瓶.