题目内容
1.上海医疗器械厂科研人员研制出不用电的化学冰箱,其原理是利用硝酸铵溶于水时的吸热作用,其化学式为NH4NO3,求:1)硝酸铵的式量80
2)硝酸铵中氮、氢、氧元素的质量比7:1:12.
分析 (1)根据相对分子的质量(式量)为组成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
解答 解:(1)根据相对分子的质量(式量)为组成分子的各原子的相对原子质量之和,可得硝酸铵的相对分子质量为14×2+4+16×3=80.故填:80;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得硝酸铵中氮、氢、氧元素的质量比为(14×2):(1×4):(16×3)=7:1:12.故填:7:1:12.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
12.某市发生了一起亚硝酸钠中毒事件.亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体.请结合下表信息,判断以下区别亚硝酸钠和氯化钠的方法错误的是( )
| 亚硝酸钠(NaNO2) | 氯化钠(NaCl) | |
| 跟稀盐酸作用 | 放出红棕色的气体 | 无反应 |
| 跟硝酸银溶液作用 | 生成浅黄色沉淀 | 生成白色沉淀 |
| A. | 滴加稀盐酸 | B. | 加热 | C. | 品尝味道 | D. | 滴加硝酸银溶液 |
9.汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸,现用1kg 98%的浓硫酸配制该稀硫酸.下列说法中正确的是( )
| A. | 28%的稀硫酸中溶质与溶剂的质量比为28:100 | |
| B. | 用lkg 98%的浓硫酸可配制3.5kg 28%的稀硫酸 | |
| C. | 配制该稀硫酸时,把水沿容器内壁缓慢注入浓硫酸中 | |
| D. | 配制好的稀硫酸可以存放在铁制容器中 |
13.实验测得某些食物的近似pH如下,下列说法正确的是( )
| 食物 | 泡菜 | 葡萄 | 番茄 | 苹果 | 牛奶 | 玉米粥 |
| pH | 3.4 | 4.2 | 4.4 | 3.1 | 6.5 | 7.8 |
| A. | 胃酸过多的人应少食泡菜 | B. | 用湿润的pH试纸蘸取葡萄汁测其pH | ||
| C. | 番茄的酸性比苹果强 | D. | 牛奶和玉米粥均属于碱性食物 |
10. 某同学发现了标签部分破损且装有无色溶液的试剂瓶一个(如图),他们想指导内盛的是什么物质,因此,他们进行了如下探究
某同学发现了标签部分破损且装有无色溶液的试剂瓶一个(如图),他们想指导内盛的是什么物质,因此,他们进行了如下探究
【提出问题】试剂瓶中盛的是什么物质?
【提出猜想】猜想Ⅰ:NaOH溶液;猜想Ⅱ:Na2CO3溶液;猜想Ⅲ:Na2SO4溶液;
猜想Ⅳ:NaCl溶液(再写一种猜想即可)
【设计实验】该小组为验证“猜想Ⅰ”、“猜想Ⅱ”是否正确,设计并完成如表所示实验
【分析与推理】当完成“实验一”后,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是NaOH溶液、Na2CO3溶液都显碱性,pH>7.
【实验与结论】实验全部完成后,正确的应是猜想Ⅱ.
【反思与评价】经过讨论,同学们认为“实验一”存在明显操作错误,该错误是pH试纸浸入待测液中,污染了待测液.
 某同学发现了标签部分破损且装有无色溶液的试剂瓶一个(如图),他们想指导内盛的是什么物质,因此,他们进行了如下探究
某同学发现了标签部分破损且装有无色溶液的试剂瓶一个(如图),他们想指导内盛的是什么物质,因此,他们进行了如下探究【提出问题】试剂瓶中盛的是什么物质?
【提出猜想】猜想Ⅰ:NaOH溶液;猜想Ⅱ:Na2CO3溶液;猜想Ⅲ:Na2SO4溶液;
猜想Ⅳ:NaCl溶液(再写一种猜想即可)
【设计实验】该小组为验证“猜想Ⅰ”、“猜想Ⅱ”是否正确,设计并完成如表所示实验
| 实验方案 | 实验一 | 实验二 | 实验三 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对照比色卡,pH>7 | 有无色无味气体产生 | 有白色沉淀产生 |
【实验与结论】实验全部完成后,正确的应是猜想Ⅱ.
【反思与评价】经过讨论,同学们认为“实验一”存在明显操作错误,该错误是pH试纸浸入待测液中,污染了待测液.
11.某学习小组研究氢氧化钙溶液的化学性质,并作了延伸探究.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
【提出问题】实验方案(3)褪色后溶液中的溶质是什么?
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙;②氯化钙和氯化氢;③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是氢氧化钙溶液能使酚酞试液变红色,既然红色褪为无色,说明氢氧化钙已经完全反应.
探究二:
丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象先产生气泡,后产生沉淀.

【得出结论】乙同学的猜想中,②(填序号)合理.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
| 方案 | (1) | (2) | (3) |
| 实验操作 | 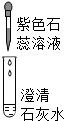 | 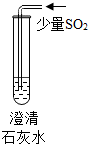 |  |
| 现象 | 溶液变蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 Ca(OH)2+SO2═CaSO3↓+H2O | 氢氧化钙溶液能与酸发生中和反应 |
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙;②氯化钙和氯化氢;③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是氢氧化钙溶液能使酚酞试液变红色,既然红色褪为无色,说明氢氧化钙已经完全反应.
探究二:
丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象先产生气泡,后产生沉淀.

【得出结论】乙同学的猜想中,②(填序号)合理.

 归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出如图.图中“-”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是A-D中的( )
归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出如图.图中“-”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是A-D中的( )