题目内容
17.现有工厂丢弃的废铜屑(铜屑表面呈绿色).课外活动小组同学欲利用其制取硫酸铜晶体,他们设计了下面的两种制取流程(如图1).请回答: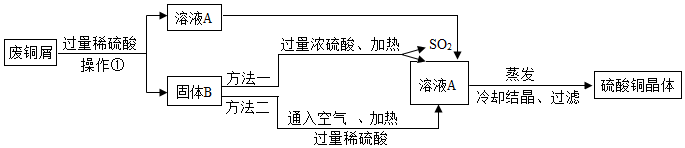
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,从组成分析,预测它除了能与稀硫酸反应后,还能与盐酸等(任举一例)反应.操作①所用的玻璃仪器有烧杯、玻璃棒和漏斗;溶液A的溶质有CuSO4、H2SO4;两种方法得到硫酸铜晶体,你觉得符合绿色化学要求的方法是方法二.
(2)方法二的化学反应的化学方程式为2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
(3)硫酸铜晶体广泛应用在电镀、印染、农药等方面,波尔多液是一种农业常用杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁制容器来配制波尔多液的原因是(用化学方程式表示)Fe+CuSO4=Cu+FeSO4,此反应属于基本反应类型中的置换反应.
(4)理论上废铜屑中的铜完全可以转化为硫酸铜.已知废铜屑的质量为100kg,若最后所得的硫酸铜质量为80kg,则废铜屑中铜的质量分数为32%.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,从组成分析,由于其是难溶性盐,所以根据复分解反应的反应物的特征(有酸可不溶,无酸需都溶),由于铜绿是难溶性的,所以发生复分解反应只能和酸反应,所以它除了能与稀硫酸反应后,还能与盐酸、硝酸等反应.操作①是固液分离,为过滤,所用的玻璃仪器有烧杯、玻璃棒和 漏斗;溶液A的溶质是过量硫酸和铜绿反应所得,所以有生成的 CuSO4和剩余的H2SO4;两种方法得到硫酸铜晶体,方法一消耗硫酸多,且是浓硫酸,不安全,同时生成了有毒的二氧化硫,所以从绿色化学的要求角度方法二更好.
(2)方法二的化学反应根据质量守恒定律和给出的部分已经配平物质可推得最后的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O.
(3)波尔多液是一种农业常用杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁制容器来配制波尔多液的原因是铁比铜活泼,能够把铜从对应的可溶性铜盐中置换出来,降低了药效,对应的化学方程式为 Fe+CuSO4=Cu+FeSO4,是单质和化合物反应生成新的单质和新的化合物,为基本反应类型中的置换反应.
(4)理论上废铜屑中的铜完全可以转化为硫酸铜.已知废铜屑的质量为100kg,若最后所得的硫酸铜质量为80kg,对应的铜元素的质量为80kg×$\frac{64}{64+32+16×4}$×100%=32kg,则废铜屑中铜的质量分数为$\frac{32kg}{100kg}$×100%=32%.
故答案为:
(1)盐酸或者硝酸等; 漏斗; CuSO4、H2SO4(化学式和名称都可以); 方法二.
(2)O2 2H2O.
(3)Fe+CuSO4=Cu+FeSO4; 置换.
(4)32%.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

| A. | 碘酒中的碘 | B. | 盐水中的盐 | C. | 食醋中的醋 | D. | 泥水中的泥 |
 2月7日《自然》杂志消息:中国科技大学的研究人员利用钴和氧化钴混合物的特定的原子排列方法,制得一种可以将CO2转化为液体燃料的电化学催化剂,如图为钴元素在周期表中的信息,下列有关说法错误的是( )
2月7日《自然》杂志消息:中国科技大学的研究人员利用钴和氧化钴混合物的特定的原子排列方法,制得一种可以将CO2转化为液体燃料的电化学催化剂,如图为钴元素在周期表中的信息,下列有关说法错误的是( )| A. | 钴原子的核电核数为27 | |
| B. | CO2转化为液体燃料过程中催化剂质量不变 | |
| C. | 钴是金属元素 | |
| D. | 钴原子的相对原子质量是58.93g |
| A. | KMnO4 | B. | KClO3 | C. | KCl | D. | O2 |
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中少量的CO | 点燃 |
| B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |




