题目内容
1.有一份已经变质的NaOH样品100g,测得其中含Na元素46%,现向该样品中加入100g稀盐酸,恰好完全反应得到中性溶液,蒸干该溶液得到的固体质量为( )| A. | 117g | B. | 46g | C. | 80g | D. | 106g |
分析 氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,已经变质的NaOH样品中含有氢氧化钠和碳酸钠,氢氧化钠和稀盐酸反应生成氯化钠和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠和碳酸钠中的钠元素都转化到氯化钠中,根据钠元素的质量可以计算氯化钠的质量.
解答 解:设蒸干该溶液得到的固体氯化钠质量为x,
100g样品中含有的钠元素质量为:100g×46%=46g,
由NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑ 可知,Na~NaCl,
Na~NaCl,
23 58.5
46g x
$\frac{23}{46g}$=$\frac{58.5}{x}$,
x=117g,
故选:A.
点评 氢氧化钠、碳酸钠和稀盐酸反应后,氢氧化钠和碳酸钠中的钠元素完全转化到氯化钠中,这是解答本题的关键,要注意理解.

练习册系列答案
相关题目
11.下列反应,既不属于分解反应,又不属于化合反应的是( )
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 碳酸钙$\stackrel{高温}{→}$氧化钙+二氧化碳 | ||
| C. | 氢气+氧气$\stackrel{点燃}{→}$水 | D. | 锌+硫酸→硫酸锌+氢气 |
16.下列各组物质,只需用组内溶液相互混合,就能鉴别出来的是( )
| A. | Na2SO4、BaCl2、KNO3、NaCl | B. | HCl、K2CO3、Ba (NO3)2、Na2SO4 | ||
| C. | NaOH、MgCl2、Na2SO4、CuSO4 | D. | KCl、AgNO3、NaCl、FeCl3 |
6.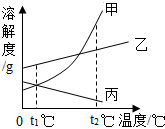 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )
 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )| A. | 三种物质溶解度大小依次为:乙>丙>甲 | |
| B. | 将温度由t2℃降到t1℃时,析出甲的质量比乙多 | |
| C. | 若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯 | |
| D. | 将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙=甲 |
13.硅是信息技术的关键材料,高温下氢气与四氯化硅(SiCl4)反应可制得 高纯度的硅,该反应的化学反应方程式为:2H2+SiCl4$\frac{\underline{\;高温\;}}{\;}$Si+4X,下列说法正确的是( )
| A. | 推出 X 是氯化氢气体,它溶于水可制成盐酸 | |
| B. | 该反应可以在有氧气或水蒸气存在的条件下进行 | |
| C. | 四氯化硅是由一个硅原子和四个氯原子构成 | |
| D. | 该生产过程中的氢气可用碳单质代替 |
11.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.17g;②第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+ | B. | 无法确定CO32-是否存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
