题目内容
为测定锌铜合金中锌的含量,取该合金放入如图 14 盛有稀硫酸的锥形瓶中,发生反应: Zn+H2SO4=ZnSO4+H2↑。多次实验后,取平均值所得数据如下表:

| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。
【答案】(1)0.4g (2)81.25%
【解析】
试题分析:有关化学方程式的就是按照有关化学方程式的简单计算的步骤:(1)设未知数(2)依据题意写方程式(3)写出相关量(4)列比例式求解(5)简单写出答案。该题中合金总共为16g ,但只有Zn和稀硫酸发生反应,通过反应前后质量的变化求出H2的质量,在通过H2的质量求出Zn的质量,进一步就出Zn的质量分数。
解:依题意可得
(1)氢气的质量=342.10g+16.00g-357.70g=0.4g
答:氢气的质量为0.4g
(2)解:设该合金中锌的质量为xg
Zn + H2SO4=ZnSO4+H2↑
65 2
x 0.4g
 =
=
解得x=13g
答:该合金中锌的质量分数为 ×100%=81.25%
×100%=81.25%
考点:考查根据化学方程式进行的计算

 名校课堂系列答案
名校课堂系列答案
 |
请根据下列实验示意图回答有关问题:
(1)根据图①中的实验现象,说明二氧化碳具有的物理性质是 ▲ 。
(2)图②的实验中,在容积为150mL的集气瓶中装入50mL水后,连好仪器,按下热的玻璃棒,白磷立即被点燃。若实验非常成功,最终集气瓶中水的体积约为 ▲ mL。
(3)图③是模拟工业炼铁的实验。若实验完成后,发现过量的澄清石灰水增重4.4g,则通入该装置的CO气体质量肯定 ▲ 2.8g(填写“>”、“<”或“=”),其理由是 ▲ 。
某兴趣小组用图22所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
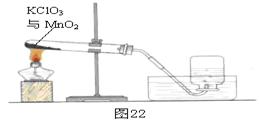
| 加热时间/min | 0 | t1 | t2 | t3 |
| 固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(1)共制得氧气 g。
(2)计算所得氯化钾溶液的溶质质量分数。
 如图所示为实验室常用的实验装置:
如图所示为实验室常用的实验装置:
据此回答下列问题:
(1)写出带标号仪器的名称:① ;② 。
(2)实验室制取二氧化碳选用的装置组合是 (填字母),写出实验室制取二氧化碳的化学方程式 。用该装置在实验室还能制取其他气体,请写出一个相应的化学方程式是 。
(3)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是 (填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(4)氯气是一种黄绿色有强烈刺激性气味的剧毒气体,密度大于空气且易溶于水,但不溶于饱和食盐水,却极易与氢氧化钠溶液反应。氯化氢气体极易溶于水。实验室制取氯气的操作步骤是:选择药品→发生装置→除杂装置→收集装置→尾气处理装置。
 其反应原理:MnO2 +4HCl(浓) MnCl2 +Cl2↑+2H2O
其反应原理:MnO2 +4HCl(浓) MnCl2 +Cl2↑+2H2O
 根据以上信息和下列装置图回答有关问题:
根据以上信息和下列装置图回答有关问题:
 | |||||
 | |||||
 | |||||

|
① 你认为适合实验室制取氯气的发生装置是 (填“A”、“B”或“C”)。
② 除杂装置和吸收装置中药品依次为____________(选填“a”、“b”或“c”)。
a. 浓硫酸 饱和食盐水 氢氧化钠溶液
b. 氢氧化钠溶液 浓硫酸 饱和食盐水
c. 饱和食盐水 浓硫酸 氢氧化钠溶液

