题目内容
8.金属用途广泛,其结构和性质等是化学的重要研究内容.(1)如图
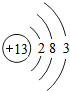 是铝的原子结构示意图.下列说法不正确的是C.
是铝的原子结构示意图.下列说法不正确的是C.A.铝原子的质子数为13
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了图1实验,并对溶液A和固体B的成分进行了分析和实验探究.
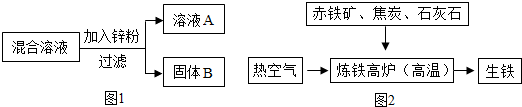
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2②有Zn (NO3)2、AgNO3③有 Zn (NO3)2、Cu(NO3)2
④有Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是(填标号),其理由是:②,Zn应先与AgNO3反应,后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2.
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 取少量固体B, 滴加稀盐酸 | 有气泡 产生 | Zn+2HCl=ZnCl2+H2↑ |
(4)某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸49t(其H2SO4的质量分数为10%),与足量废铁屑起反应,可生产硫酸亚铁的质量是多少?
分析 (1)A、根据铝原子的核外电子排布进行分析;
B、根据铝的化合价进行分析;
C、根据铝在地壳中的含量进行分析;
D、根据铝的导电性进行分析.
(2)【交流讨论】根据金属活动性顺序表的应用分析猜想;
【实验探究】根据金属活动性顺序表的应用设计实验探究B的成分;
(3)根据碳的性质分析在炼铁炉中焦炭的作用,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳进行分析;
(4)根据反应的化学方程式结合提供的数据进行分析解答即可.
解答 解:(1)A、原子结构示意图中圆圈内数字就是质子数,所以铝原子质子数是13,故A正确;
B、由于铝原子最外层电子数是3易失去3个电子,显+3价,故B正确;
C、地壳中含量最多的元素是“氧元素”,故C错误;
D、铝做导线就是因为铝具有导电性,故D正确.
故填:C;
(2)【交流讨论】猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银,也就是说只要有硝酸银时,一定也含有硝酸铜;故填:②,Zn应先与AgNO3反应,后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2;
【实验探究】如果猜想①成立说明锌把硝酸银、硝酸铜都反应完了,如果能鉴别出剩余固体中含有锌,就能说明锌过量,铜和银都被它置换出来,由于锌能与酸反应产生氢气,所以向固体中加入盐酸,如果有气体产生,说明锌有剩余;故填:
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 取少量固体B, 滴加 稀盐酸 | 有气泡 产生 | Zn+2HCl=ZnCl2+H2↑ |
(4)废硫酸中溶质的质量为:49t×10%=4.9t,设生成硫酸亚铁的质量为x
Fe+H2SO4═FeSO4+H2↑
98 152
4.9t x
$\frac{98}{152}=\frac{4.9t}{x}$
x=7.6t
答:可生产硫酸亚铁的质量是7.6t.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.小军同学在学习酸碱盐有关知识时,对一些沉淀物的颜色产生了兴趣.老师告诉他氢氧化铜是蓝色、氢氧化铁是红褐色,让他自己探究氢氧化亚铁的颜色.下面请你和他一起探究.
【查阅资料】
(1)铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得.
(2)氢氧化亚铁在空气中立即被氧化.
(3)硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色.
【提出猜想】氢氧化亚铁是浅绿色.
【实验过程】在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象.请补充完成下表:
【反思交流】
(1)氢氧化亚铁是白色而不是浅绿色.
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液.你认为小军的理由是单质的铁也可以将FeCl3还原成FeCl2.
【查阅资料】
(1)铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得.
(2)氢氧化亚铁在空气中立即被氧化.
(3)硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色.
【提出猜想】氢氧化亚铁是浅绿色.
【实验过程】在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象.请补充完成下表:
| FeCl3溶液 | FeSO4溶液 | |
| 滴入NaOH溶液的现象 | 生成红褐色沉淀 | 先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀. |
化学方程式 | FeCl3+3NaOH=Fe(OH)3↓+3NaCl 基本反应类型属于 复分解反应反应. | FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 Fe(OH)2+O2+H2O=Fe(OH)3 (用化学式填写空白,不需配平) |
(1)氢氧化亚铁是白色而不是浅绿色.
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液.你认为小军的理由是单质的铁也可以将FeCl3还原成FeCl2.
16.下列实验操作或做法正确的是( )
| A. | 用高锰酸钾制氧气,加热时试管的管口应略向下倾斜 | |
| B. | 制备气体前,先装药,然后检查装置的气密性 | |
| C. | 实验结束后,可以用嘴吹灭酒精灯 | |
| D. | 将用剩的药品放回原试剂瓶 |
3.小雨同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题,她设计并完成了如表所示的探究实验:
(1)请你帮小雨同学填写上表中未填完的空格
(2)小英同学认为仅由上述实验还不能完全表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.第一方面的实验操作中包含了两次称量,其目的是:对比验证二氧化锰反应前后质量没有发生变化;
(3)第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验.接下来的实验操作、现象和结论是继续加入过氧化氢溶液并伸入带火星的木条,有大量气泡产生带火星的木条复燃,证明过氧化氢的化学性质没有发生改变.
| 实验操作 | 实验现象 | 实验结论 | 总结 | |
| 实验一 | 取5mL 5%过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,只是反应速率较慢 | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有气泡产生,木条不复燃 | 二氧化锰加入水中,不产生氧气 | |
| 实验三 | 向盛有5mL5%的过氧化氢溶液的试管中,加入二氧化锰,并伸入带火星的木条 | 大量气泡产生,带火星的木条迅速复燃 | 二氧化锰能加快过氧化氢的分解 |
(2)小英同学认为仅由上述实验还不能完全表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.第一方面的实验操作中包含了两次称量,其目的是:对比验证二氧化锰反应前后质量没有发生变化;
(3)第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验.接下来的实验操作、现象和结论是继续加入过氧化氢溶液并伸入带火星的木条,有大量气泡产生带火星的木条复燃,证明过氧化氢的化学性质没有发生改变.
13.现甲、乙两化学小组安装两套如图1的相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素.
①下列方法能检查该装置气密性的是AB.
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
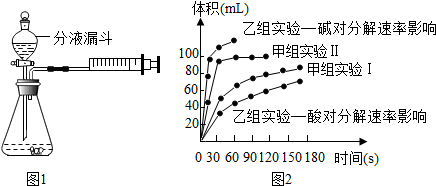
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
②二氧化锰催化下过氧化氢分解的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
③甲小组有如下实验设计方案,完成下表.
④甲、乙两小组得出如图2的数据.
Ⅰ甲组实验得出的数据可知:浓度越大,过氧化氢分解速率越快;
Ⅱ由乙组研究的酸、碱对过氧化氢分解影响因素的数据分析:相同条件下,过氧化氢在碱(填“酸”或“碱”)性环境下放出气体速率较快.
①下列方法能检查该装置气密性的是AB.
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.

C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
②二氧化锰催化下过氧化氢分解的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
③甲小组有如下实验设计方案,完成下表.
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对过氧化氢分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%过氧化氢 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%过氧化氢 |
Ⅰ甲组实验得出的数据可知:浓度越大,过氧化氢分解速率越快;
Ⅱ由乙组研究的酸、碱对过氧化氢分解影响因素的数据分析:相同条件下,过氧化氢在碱(填“酸”或“碱”)性环境下放出气体速率较快.
17.下列变化中,发生了化学变化的是( )
| A. | 菜刀生锈 | B. | 水变成水蒸气 | C. | 矿石粉碎 | D. | 蜡烛熔化 |
18.决定元素种类的是( )
| A. | 核外电子数 | B. | 质子数 | C. | 最外层电子数 | D. | 中子数 |
 某兴趣小组同学按如图组装仪器进行实验,请回答下列有关问题:
某兴趣小组同学按如图组装仪器进行实验,请回答下列有关问题: