题目内容
8.细铁丝在氧气中点燃燃烧,生成物质的质量比铁丝的质量增加了,是因为根据质量守恒定律,铁丝在氧气中点燃燃烧生成的四氧化三铁的质量等于铁的质量与参加反应的氧气的质量之和,故比铁丝的质量增加了;加热高锰酸钾后,残余固体的质量比反应前高锰酸钾的质量减少了,是因为根据质量守恒定律,被分解的高锰酸钾的质量等于剩余固体和生成的氧气的质量之和,氧气扩散到空气中,因此加热高锰酸钾后留下的固体物质的质量比高锰酸钾的质量小;这两种现象都可以用质量守恒定律来解释.分析 在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以质量守恒定律只能用来解释化学反应,可以据此解答
解答 解:根据质量守恒定律,铁丝在氧气中点燃燃烧生成的四氧化三铁的质量等于铁的质量与参加反应的氧气的质量之和,故比铁丝的质量增加了;
根据质量守恒定律,被分解的高锰酸钾的质量等于剩余固体和生成的氧气的质量之和,氧气扩散到空气中,因此加热高锰酸钾后留下的固体物质的质量比高锰酸钾的质量小.
这两种现象都可以用质量守恒定律来解释.
答:根据质量守恒定律,铁丝在氧气中点燃燃烧生成的四氧化三铁的质量等于铁的质量与参加反应的氧气的质量之和,故比铁丝的质量增加了;
根据质量守恒定律,被分解的高锰酸钾的质量等于剩余固体和生成的氧气的质量之和,氧气扩散到空气中,因此加热高锰酸钾后留下的固体物质的质量比高锰酸钾的质量小.
质量守恒定律.
点评 本题主要考查学生对质量守恒定律的认识和灵活运用这一定律解答问题的能力,质量守恒定律适用于所有的化学变化.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
18.下列有关资源、能源的叙述错误的是( )
| A. | 空气中含量最多的单质是氮气 | |
| B. | 按目前测定,海水中含量最多的元素是氧元素 | |
| C. | 煤、石油、沼气、风能等都是可再生能源 | |
| D. | 防止金属腐蚀是保护金属资源的有效途径 |
19.某花圃的花卉缺乏磷元素,应施用的化肥是( )
| A. | K2CO3 | B. | NH4NO3 | C. | P2O5 | D. | Ca3(PO4)2 |
16.下列说法正确的是( )
| A. | 氮气可用作保护气,说明氮气不与任何物质发生反应 | |
| B. | 做硫在氧气中燃烧实验时,在集气瓶中留少量水可吸收二氧化硫 | |
| C. | 氧气易溶于水,可以供给水中植物呼吸 | |
| D. | 常用带火星的木条检验空气中的氧气 |
3. 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:
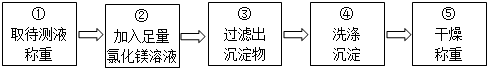
(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,如果不产生白色沉淀,说明已经洗净,如果产生白色沉淀,说明没有洗净(写出实验步骤、现象和结论).
(5)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠. |
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:

(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,如果不产生白色沉淀,说明已经洗净,如果产生白色沉淀,说明没有洗净(写出实验步骤、现象和结论).
(5)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
8.如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
(1)在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中.改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是20℃~70℃(硝酸钾和氯化钠溶解度互不影响),当改变温度的过程中NaCl在溶液中恰好饱和时,溶液中KNO3和溶剂的质量比为8:25.
(2)向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤.

①~⑤中溶液为饱和状态的是②⑤(填序号①-⑤,①-⑤中A溶液中溶质质量分数相等的是④⑤(填序号①-⑤).
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(2)向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤.

| 资料:A的溶解度 | |||||
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
 (1)水在自然环境中不易分解,但在通电的条件下可以分解,写出该反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,在如图所示的装置中,当通电一段时间后,甲管中气体的体积与乙管中气体的体积之比为1:2.
(1)水在自然环境中不易分解,但在通电的条件下可以分解,写出该反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,在如图所示的装置中,当通电一段时间后,甲管中气体的体积与乙管中气体的体积之比为1:2.
