题目内容
14.化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.【查阅资料】蜡烛的主要成分是石蜡,石蜡由碳、氢两种元素组成.氢氧化钙的溶解度随温度的升高而减小.
【实验探究1】为了探究蜡烛完全燃烧的产物是二氧化碳和水,同学们作了如下实验.
(1)用干冷的小烧杯罩在蜡烛火焰上,观察到烧杯内壁出现水珠,证明有水生成.
(2)将涂有饱和石灰水的小烧杯罩在蜡烛火焰上,若石灰水变浑浊,证明有二氧化碳生成.写出二氧化碳和石灰水反应的化学方程式Ca(OH)2+CO2═CaCO3↓+H2O.
【反思质疑】小明提出:石灰水变浑浊不一定是生成了碳酸钙,还可能是饱和石灰水受热后析出了氢氧化钙.
【实验探究2】同学们对“实验探究1”进行改进:将点燃的蜡烛放到集气瓶底部,再将瓶口盖严,蜡烛很快熄灭.然后取出蜡烛,向冷却后的集气瓶里注入适量的饱和石灰水,振荡,石灰水立即变浑浊,确认有二氧化碳生成.
【交流讨论】“实验探究2”中,小明观察到集气瓶内壁上有少量黑色粉末.经讨论,同学们一致认为黑色粉末是石蜡不完全燃烧生成的炭黑.
【查阅资料】蜡烛不完全燃烧,不仅生成上述黑色粉末,还可能生成一氧化碳.且黑色粉末与一氧化碳的化学性质相似,都能和氧化铁反应生成铁.
【实验探究3】为探究蜡烛不完全燃烧是否生成一氧化碳,他们设计了如图所示的实验.
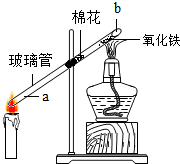
(1)将玻璃管的a端插入蜡烛的焰心,蜡烛不完全燃烧的产物就会进入玻璃管内.
(2)为了阻止炭黑和氧化铁反应,在玻璃管中部,提前放入了一团棉花.
(3)先点燃蜡烛,稍后点燃酒精灯加热氧化铁;一会儿,红棕色氧化铁逐渐变成黑色,证明蜡烛不完全燃烧确实有一氧化碳生成.b端发生反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)为防止玻璃管b端生成的黑色物质又被氧化,接下来的操作是先熄灭酒精灯,一会儿后再熄灭蜡烛.
【拓展应用】含碳燃烧不完全燃烧,既浪费资源,又污染空气.为使其完全燃烧,可以采取的一条措施是增大燃料和氧气的接触面积.
分析 【实验探究1】
水蒸气冷凝后变成水珠;
氢氧化钙和二氧化碳反应生成碳酸钙和水;
【反思质疑】
饱和氢氧化钙溶液温度升高时会析出固体;
【交流讨论】
石蜡不完全燃烧能生成炭黑等物质;
【实验探究3】
棉花可以阻止炭黑和氧化铁接触;
氧化铁在高温条件下能和一氧化碳反应生成铁和二氧化碳;
铁在高温条件下能够被空气中的氧气氧化;
增大可燃物与氧气的接触面积,增大氧气的浓度,都能够促进可燃物燃烧.
解答 解:【实验探究1】
(1)用干冷的小烧杯罩在蜡烛火焰上,观察到烧杯内壁出现水珠,证明有水生成.
(2)二氧化碳和石灰水反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:烧杯内壁出现水珠;Ca(OH)2+CO2═CaCO3↓+H2O.
【反思质疑】
石灰水变浑浊不一定是生成了碳酸钙,还可能是饱和石灰水受热后析出了氢氧化钙.
故填:析出了氢氧化钙.
【交流讨论】
“实验探究2”中,集气瓶内壁上的黑色粉末可能是石蜡不完全燃烧生成的炭黑.
故填:炭黑.
【实验探究3】
(2)为了阻止炭黑和氧化铁反应,在玻璃管中部,提前放入了一团棉花;
(3)一会儿,红棕色氧化铁逐渐变成黑色,证明蜡烛不完全燃烧确实有一氧化碳生成;
b端发生反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)为防止玻璃管b端生成的黑色物质又被氧化,接下来的操作是先熄灭酒精灯,一会儿后再熄灭蜡烛.
故填:炭黑和氧化铁反应;红棕;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;先熄灭酒精灯,一会儿后再熄灭蜡烛.
【拓展应用】
为使其完全燃烧,可以采取的方法是:增大可燃物与氧气的接触面积,增大氧气的浓度.
故填:增大燃料和氧气的接触面积.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式:CuCl2+2NaOH=Cu(OH)2↓+2 NaCl.
(2)用pH试纸测定滤液的 pH=7.
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:NaCl;猜想ⅡNaCl、BaCl2;猜想ⅢNaCl、Na2SO4.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验②取少量滤液于试管中,滴加适量的BaCl2溶液(写溶质的化学式),振荡. | 产生白色沉淀 | 猜想Ⅲ成立 |
| A. | 用燃磷法测定空气中氧气的体积含量 | |
| B. | 除去烧碱中混有的纯碱,可以使用稀盐酸 | |
| C. | 测定未知溶液的pH时,要先将pH试纸用水湿润 | |
| D. | 稀释浓硫酸时,向浓硫酸中缓缓加水,并用玻璃棒搅拌 |
| A. | 干冰用于人工降雨 | B. | 石墨可做电极 | ||
| C. | 氧气可用作燃料 | D. | 氢氧化钙能改良酸性土壤 |
| A. | K2CO3 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | NH4HCO3 |
| A. |  稀释浓硫酸 | B. |  蒸发溶液 | C. |  称量固体质量 称量固体质量 | D. |  测溶液的pH |
