题目内容
14.实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
| 实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
| Ⅰ | 16.0 | 60.0 | 0.5 |
| Ⅱ | 16.0 | 130.0 | 1.0 |
| Ⅲ | 16.0 | 150.0 | 1.0 |
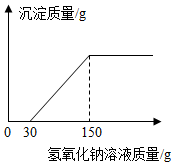
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示.计算盐酸的质量分数.(写出计算过程)
分析 (1)根据氧化镁与盐酸反应生成氯化镁和水,镁与盐酸反应生成氯化镁和氢气,根据生成的氢气的质量结合化学方程式计算镁的质量,样品中金属镁的质量百分含量;
(2)盐酸与氢氧化钠反应生成氯化钠和水,氯化镁与氢氧化钠反应生成氢氧化钠和氯化钠,根据氢氧化钠的质量计算氯化氢的质量,进一步计算盐酸的质量分数.
解答 解:(1)对比第Ⅱ、Ⅲ组中发现,对比第Ⅲ组中所加盐酸质量有130g增加到150g时,氢气的质量没有增加,说明第Ⅲ组中镁完全反应,
设样品中金属镁的质量为x,
Mg+2HCl=MgCl2+H2↑
24 2
x 1.0g
$\frac{24}{x}=\frac{2}{1.0g}$
x=12.0g
样品中金属镁的质量百分含量为:$\frac{12.0g}{16.0g}×100%$=75.0%.
(2)MgO+2HCl=MgCl2+H2O,Mg+2HCl=MgCl2+H2↑,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,HCl+NaOH=NaCl+H2O,可得关系式:HCl~NaOH,设150.0g稀盐酸中氯化氢的质量为y
HCl~NaOH
36.5 40
y 150g×40%
$\frac{36.5}{y}=\frac{40}{150g×40%}$
y=54.75g
盐酸的质量分数为$\frac{54.75g}{150.0g}×100%$=36.5%.
答:(1)样品中金属镁的质量百分含量为75.0%.
(2)盐酸的质量分数为36.5%.
点评 本题考查混合物的计算,题目难度较大,注意根据有关反应的方程式计算相关物理量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列实验能用如图表示的是( )


| A. | 向一定质量的硫酸铜溶液中加入铁粉 | |
| B. | 常温下,向饱和的澄清石灰水中加入氧化钙 | |
| C. | 向一定质量的稀硫酸中加入锌片 | |
| D. | 常温下,向饱和的硝酸钾溶液中加入硝酸钾 |
2.下列是生活中常见的现象,不属于化学变化的是( )
| A. | 菜刀生锈 | B. | 米饭变馊 | C. | 马铃薯腐烂 | D. | 用淘米水洗菜 |
9.下列叙述正确的是( )
| A. | 含碳元素的化合物一定是有机物 | |
| B. | 合金都是由两种或多种金属熔合而成 | |
| C. | 门捷列夫发现了元素周期律 | |
| D. | 汽油着火,立即喷水灭火 |
19.实验室里发生的下列变化,属于化学变化的是( )
| A. | 盐酸挥发 | B. | 试管破碎 | C. | 石蜡燃烧 | D. | 胆矾研碎 |
6.在阳台上用营养液进行无土栽培蔬菜,已成为城镇居民“亲近自然,享受绿色生活”的家庭时尚,营养液配方中属于复合肥料的是( )
| A. | CO(NH2)2 | B. | K2SO4 | C. | NH4H2PO4 | D. | Ca(H2PO4)2 |
3.下列图象与所对应操作相符的是( )
| A. |  用两份等质量、等质量分数的过氧化氢溶液制取氧气 | |
| B. |  向一定质量分数的盐酸中不断加水 | |
| C. |  向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 | |
| D. |  向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液 |
4. 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
(1)第5次加入稀盐酸时,烧杯中烧杯中溶质是AlCl3、HCl
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
 小金通过图示装置验证CO2能与NaOH发生化学反应.推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,振荡集气瓶后打开止水夹.
小金通过图示装置验证CO2能与NaOH发生化学反应.推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,振荡集气瓶后打开止水夹.