题目内容
9.“三效催化转化器”可将汽车尾气中有毒气体处理为无毒气体,反应前后分子变化的微观示意图如下.请回答:
(1)写出上述变化的化学方程式2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(2)上图中一共有4种分子.如图这些物质中不属于氧化物的是N2.(写化学式)
(3)消耗56g
 才能产生28g
才能产生28g .
.
分析 (1)观察反应前后分子变化的微观示意图,分子反应物、生成物,写出反应的化学方程式;
(2)根据微粒的构成分析物质的类别;
(3)根据反应的化学方程式计算;
解答 解:(1)由上图可知,反应物为一氧化碳和一氧化氮,生成物是二氧化碳和氮气,反应条件是催化剂,反应的方程式是:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(2)由微粒的构成可知,上图中一共有4种分子.从物质分类的角度来看,上图中物质不属于氧化物的是N2,属于单质;
(3)设需要一氧化碳的质量为x
2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2
56 28
x 28g
$\frac{56}{x}=\frac{28}{28g}$
x=56g
答案:
(1)2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
(2)4; N2;
(3)56
点评 根据变化微观示意图及粒子构成模拟图,确定物质的分子构成,能够正确写出物质的化学式,是解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.实验室里发生的下列变化,属于化学变化的是( )
| A. | 盐酸挥发 | B. | 试管破碎 | C. | 石蜡燃烧 | D. | 胆矾研碎 |
20.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是( )
| A. | 定期用清水冲洗,除去灰尘 | B. | 放于体验区,让观众触摸 | ||
| C. | 用盐水除去铁剑上的锈斑 | D. | 放在充满氮气的展览柜中 |
17.甲、乙两种物质的溶解度曲线如图所示.下列说法正确的是( )


| A. | 依据溶解度曲线可判断,甲的溶解度比乙大 | |
| B. | 10℃时,甲、乙饱和溶液溶质的质量相同 | |
| C. | 20℃时,把30g甲放入50g水中形成的溶液中溶质质量分数为37.5% | |
| D. | 将20℃时的甲、乙饱和溶液升温至30℃,甲、乙溶液中溶质的质量分数均不变 |
4.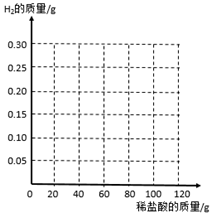 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
(1)第5次加入稀盐酸时,烧杯中烧杯中溶质是AlCl3、HCl
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
14.现有25℃时含有7.4g溶质的饱和澄清石灰水,请按下面要求计算:
(1)已知25℃时Ca(OH)2的溶解度为0.16g,则上述澄清石灰水的质量为4632.4g.
(2)向上述石灰水中通入CO2,当二者恰好完全反应生成碳酸钙沉淀时,通入CO2的质量是多少克?(写出计算过程)
(3)已知持续向饱和澄清石灰水中通入CO2,会发生反应CaCO3+H2O+CO2═Ca(HCO3)2,Ca(HCO3)2易溶于水.另取一定量的饱和澄清石灰水,通入一段时间的CO2,反应物与生成物的质量如表:
则a=16.2.该反应的化学方程式为3CO2+2Ca(OH)2═CaCO3↓+H2O+Ca(HCO3)2.
(1)已知25℃时Ca(OH)2的溶解度为0.16g,则上述澄清石灰水的质量为4632.4g.
(2)向上述石灰水中通入CO2,当二者恰好完全反应生成碳酸钙沉淀时,通入CO2的质量是多少克?(写出计算过程)
(3)已知持续向饱和澄清石灰水中通入CO2,会发生反应CaCO3+H2O+CO2═Ca(HCO3)2,Ca(HCO3)2易溶于水.另取一定量的饱和澄清石灰水,通入一段时间的CO2,反应物与生成物的质量如表:
| 物质 | Ca(OH)2 | CO2 | CaCO3 | X | H2O |
| 质量/g | 14.8 | 13.2 | 10 | a | 1.8 |
1.现有25g的KOH和K2CO3固体混合物,已知K元素与C元素的质量比是39:3,把该固体全部加入到盛有100g的足量稀硫酸的烧杯中,充分反应后,烧杯里残留物质的质量是120.6g,则烧杯中硫酸钾的质量为( )
| A. | 4.8g | B. | 9.6g | C. | 17.4g | D. | 34.8g |
18.某同学用如表所示的形式对所学物质进行分类(甲包含乙、丙),下列分类错误的是( )
| 选项 | A | B | C | D |
| 甲 | 碳单质 | 构成物质微粒 | 有机化合物 | 常见的碱 |
| 乙、丙 | 金刚石、C60 | 分子、原子 | 甲烷、乙醇 | 烧碱、纯碱 |
| A. | A | B. | B | C. | C | D. | D |
19.高氯酸钾( KClO4) 可用作火箭推进剂,其溶解度如表.下列说法不正确的是( )
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度/g | 1.68 | 3.73 | 7.3 | 13.4 |
| A. | 高氯酸钾的溶解度随温度降低而减小 | |
| B. | 20℃时,将 2g高氯酸钾溶于98g水中,所得溶液中溶质的质量分数小于2% | |
| C. | 60℃时,高氯酸钾饱和溶液中溶质的质量分数小于7.3% | |
| D. | 80℃的高氯酸钾溶液冷却至40℃肯定有晶体析出 |