题目内容
15. 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.
有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1.
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2.
Ⅲ.实验数据如下表:
| 反应前总质量m1 | 反应后总质量m2 |
| 371.84g | 371.24g |
(1)配平化学方程式:2Al+2NaOH+2H2O$\frac{\underline{\;加热\;}}{\;}$2NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数.
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有B.
A.向锥形瓶中倒入样品时,撒出了部分粉末 B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量.
分析 (1)根据质量守恒定律反应前后原子的种类和数目不变进行配平;
(2)根据质量守恒定分析生成的氢气,由氢气的质量可求出铝的质量,再计算出铝的质量分数;
(3)根据实验的过程和操作分析对实验结果的影响.
解答 解:(1)由质量守恒定律可知,铝的原子个数是2个,则NaAlO2前边的计量数应配上“2”;
(2)由质量守恒定律可知,反应产生的氢气质量为371.84g-371.24g=0.6g
设参加反应的铝质量为x
2Al+2NaOH+H2O═2NaAlO2+3H2↑
54 6
x 0.6g
$\frac{54}{6}=\frac{x}{0.6g}$ 解得:x=5.4g
样品中铝的质量分数是:$\frac{5.4g}{20g}×100%$=27%
(3)A.向锥形瓶中倒入样品时,撒出了部分粉末,导致产生气体少,而计算时样品的质量依旧按照20g计算,所以偏小.
B.在反应过程中有水蒸气逸出,会使测定的氢气的质量变大,求出铝的质量偏大,会使测量结果偏高;
C.没有等装置中氢气全部排尽就称量,会使测定的氢气的质量变小,求出铝的质量偏小,会使测量结果偏低;
故答为:(1)2;(2)该样品中铝的质量分数为27%.(3)B.
点评 本题主要考查了根据化学方程式的计算,同时又是一道信息给予题,解题时认真审题,提取出题中的有用信息来分析解答问题.

练习册系列答案
相关题目
6.在阳台上用营养液进行无土栽培蔬菜,已成为城镇居民“亲近自然,享受绿色生活”的家庭时尚,营养液配方中属于复合肥料的是( )
| A. | CO(NH2)2 | B. | K2SO4 | C. | NH4H2PO4 | D. | Ca(H2PO4)2 |
3.下列图象与所对应操作相符的是( )
| A. |  用两份等质量、等质量分数的过氧化氢溶液制取氧气 | |
| B. |  向一定质量分数的盐酸中不断加水 | |
| C. |  向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 | |
| D. |  向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液 |
10.自2011年我省实施找矿战略行动以来,在铜、铅、锌、金、铁、铌、钽等金属方面取得找矿新成果.下列关于铁、锌、铜三种金属及其合金的说法不正确的是( )
| A. | 铁在潮湿的空气中易生锈 | |
| B. | 可以用铁桶盛放硫酸铜溶液 | |
| C. | 可以用稀硫酸鉴别锌与铜的金属活动性强弱 | |
| D. | 黄铜(铜与锌的合金)的硬度大于纯铜 |
20.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是( )
| A. | 定期用清水冲洗,除去灰尘 | B. | 放于体验区,让观众触摸 | ||
| C. | 用盐水除去铁剑上的锈斑 | D. | 放在充满氮气的展览柜中 |
4.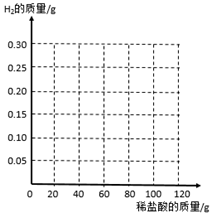 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
(1)第5次加入稀盐酸时,烧杯中烧杯中溶质是AlCl3、HCl
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
5.下列变化属于化学变化的是( )
| A. | 死灰复燃 | B. | 杯弓蛇影 | C. | 冰消雪融 | D. | 铁杵磨针 |
 小金通过图示装置验证CO2能与NaOH发生化学反应.推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,振荡集气瓶后打开止水夹.
小金通过图示装置验证CO2能与NaOH发生化学反应.推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,振荡集气瓶后打开止水夹.