题目内容
9.氯化钠生活上可用于调味品,工业上用于制造纯碱、烧碱及其他化工产品.(1)“侯氏制碱法”的第一步是制得NaHCO3:向饱和食盐水中依次通入足量NH3和CO2,析出NaHCO3固体(NaHCO3因溶解度相对较小而沉淀析出),反应前后溶液中离子的数目基本没变的是Cl-(填离子符号)
(2)氯碱工业用电解饱和食盐水制取氯气、烧碱和另一种气体单质.写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)冬天,北方下雪,道路结冰,给交通带来极大不便,交通部门使用融雪剂快速消除道路上的积雪,.某公司生产的融雪剂主要成分是NaCl、Na2SO4和MgCl2.
设计实验方案验证融雪剂中存在Na2SO4和MgCl2,完成下列表格.
限选试剂:AgNO3溶液、BaCl2溶液、NaOH溶液、蒸馏水
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:取少量“融雪剂”于烧杯中,加入足量蒸馏水,充分搅拌. | / | |
| 步骤2:取少量步骤1中的溶液于试管中,再滴加少量的BaCl2溶液,振荡. | 含有Na2SO4 | |
| 步骤3:取少量步骤1中的溶液于另一试管中,再滴加少量的NaOH溶液,振荡. | 含有MgCl2 |
分析 (1)根据向饱和食盐水中依次通入足量NH3和CO2,反应生成碳酸氢钠和氯化铵,由于碳酸氢钠的溶解度小而析出进行解答;
(2)根据氯碱工业用电解饱和食盐水制取氯气、烧碱和另一种气体单质,由质量守恒定律可知另一种气体单质是氢气进行解答;
(3)根据NaCl、Na2SO4和MgCl2都溶于水后形成无色溶液,氯化钡溶液和硫酸钠反应生成硫酸钡白色沉淀,氢氧化钠溶液和氯化镁溶液反应生成氢氧化镁白色沉淀进行解答.
解答 解:(1)向饱和食盐水中依次通入足量NH3和CO2,反应生成碳酸氢钠和氯化铵,由于碳酸氢钠的溶解度小而析出,而反应前后氯离子的浓度几乎不变;
(2)氯碱工业用电解饱和食盐水制取氯气、烧碱和另一种气体单质,由质量守恒定律可知另一种气体单质是氢气,所以反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(3)NaCl、Na2SO4和MgCl2都溶于水后形成无色溶液,氯化钡溶液和硫酸钠反应生成硫酸钡白色沉淀,氢氧化钠溶液和氯化镁溶液反应生成氢氧化镁白色沉淀,所以实验方案为:
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:取少量“融雪剂”于烧杯中,加入足量蒸馏水,充分搅拌. | 固体完全溶解,形成无色溶液 | / |
| 步骤2:取少量步骤1中的溶液于试管中,再滴加少量的BaCl2溶液,振荡. | 产生白色沉淀 | 含有Na2SO4 |
| 步骤3:取少量步骤1中的溶液于另一试管中,再滴加少量的NaOH溶液,振荡. | 产生白色沉淀 | 含有MgCl2 |
故答案为:(1)Cl-;
(2)2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(3)步骤1现象:固体完全溶解,形成无色溶液;
步骤2:取少量步骤1中的溶液于试管中,再滴加少量的BaCl2溶液,振荡;现象:产生白色沉淀;
步骤3:取少量步骤1中的溶液于另一试管中,再滴加少量的NaOH溶液,振荡; 现象:产生白色沉淀.
点评 解答本题要能够正确的书写化学方程式,要理解各种物质的性质以及实验现象,特别应该注意加入试剂的顺序.

练习册系列答案
相关题目
19.下列有关金属的说法正确的是( )
| A. | 金属铝有很好的抗腐蚀性能 | B. | 纯铝的硬度大于铝合金 | ||
| C. | 钢是纯净物 | D. | 钢铁严重锈蚀后不值得回收 |
20.下列实验操作或做法正确的是( )
| A. | 点燃氢气前,先检验其纯度 | |
| B. | 为了节约药品,将用剩余的药品放回原试剂瓶 | |
| C. | 实验结束后,用嘴吹灭酒精灯 | |
| D. | 将食盐放在托盘天平的右盘上称量 |
18.下列实验现象描述不正确的是( )
| A. | 二氧化碳气体通入紫色石蕊溶液中,溶液变红色 | |
| B. | 镁条在空气里燃烧,发出耀眼的白光,放热,产生白烟,生成白色粉末状固体 | |
| C. | 钝化的铝与硝酸铜溶液反应银白色固体表面有紫红色物质生成,放热,溶液由蓝色变为无色 | |
| D. | 肥皂水滴入硬水中,产生较少的泡沫.有浮渣 |
19.下列有关物质的化学式、名称、俗名不完全对应的是( )
| A. | NaOH 氢氧化钠 烧碱 | B. | CaO 氢氧化钙 生石灰 | ||
| C. | Na2CO3 碳酸钠 纯碱 | D. | NaCl 氯化钠 食盐 |
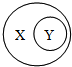 学习化学时可用右图表示某些从属关系,下列选项正确的是( )
学习化学时可用右图表示某些从属关系,下列选项正确的是( )