题目内容
物质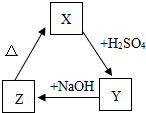 X、Y、Z之间存在如图转化关系:
X、Y、Z之间存在如图转化关系:
(1)写出X、Y、Z的化学式:X ;Y ;Z .
(2)请写出X、Y、Z之间转化的反应方程式:
①X→Y ;
②Y→Z ;
③Z→X .
 X、Y、Z之间存在如图转化关系:
X、Y、Z之间存在如图转化关系:(1)写出X、Y、Z的化学式:X
(2)请写出X、Y、Z之间转化的反应方程式:
①X→Y
②Y→Z
③Z→X
考点:物质的鉴别、推断,化学式的书写及意义,书写化学方程式、文字表达式、电离方程式
专题:框图型推断题
分析:根据物质X、Y、Z之间存在如图的转化关系,可推测X、Y、Z的化学式;
根据反应物、生成物、反应条件,结合“①X→Y;②Y→Z;③Z→X”可推测:①X→Y为酸与金属氧化物的反应;②Y→Z为盐与酸的反应;③Z→X为碱受热分解的反应,故可正确书写各化学方程式.
根据反应物、生成物、反应条件,结合“①X→Y;②Y→Z;③Z→X”可推测:①X→Y为酸与金属氧化物的反应;②Y→Z为盐与酸的反应;③Z→X为碱受热分解的反应,故可正确书写各化学方程式.
解答:解:(1)根据物质X、Y、Z之间存在如图的转化关系,可推测X、Y、Z的化学式分别为:X为 CuO或Fe2O3;Y为 CuSO4或Fe2(SO4)3;Z为 Cu(OH)2或Fe(OH)3.代入检验,符合题意.
(2)根据题意,则可写出X、Y、Z之间转化的反应的化学方程式:
①X→Y为酸与金属氧化物的反应,则化学方程式为:CuO+H2SO4=CuSO4+H2O或3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
②Y→Z盐与酸的反应,则化学方程式为:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓或Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3↓;
③Z→X为碱受热分解的反应,则化学方程式为:Cu(OH)2
CuO+H2O或2Fe(OH)3
Fe2O3+3H2O.
故答案为:(1)CuO或Fe2O3; CuSO4或Fe2(SO4)3; Cu(OH)2或Fe(OH)3.
(2)①CuO+H2SO4=CuSO4+H2O或3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
②CuSO4+2NaOH=Na2SO4+Cu(OH)2↓或Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3↓;
③Cu(OH)2
CuO+H2O或2Fe(OH)3
Fe2O3+3H2O.
(2)根据题意,则可写出X、Y、Z之间转化的反应的化学方程式:
①X→Y为酸与金属氧化物的反应,则化学方程式为:CuO+H2SO4=CuSO4+H2O或3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
②Y→Z盐与酸的反应,则化学方程式为:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓或Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3↓;
③Z→X为碱受热分解的反应,则化学方程式为:Cu(OH)2
| ||
| ||
故答案为:(1)CuO或Fe2O3; CuSO4或Fe2(SO4)3; Cu(OH)2或Fe(OH)3.
(2)①CuO+H2SO4=CuSO4+H2O或3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
②CuSO4+2NaOH=Na2SO4+Cu(OH)2↓或Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3↓;
③Cu(OH)2
| ||
| ||
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.

练习册系列答案
相关题目
如图所示是某些粒子的结构示意图,下列有关表达不正确的是 ( )

| A、化学性质相似的是乙、丁 |
| B、具有相对稳定结构的是甲 |
| C、表示同种元素的是甲、丙 |
| D、甲是稀有气体元素 |
取10.0g碳酸钙高温加热,一段时间后停止加热,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )
| A、生成2.0g CO2气体 |
| B、剩余固体的质量为5.0g |
| C、生成了5.6g CaO |
| D、剩余CaCO3的质量为8.0g |