题目内容
现有如图1所示实验装置,请回答下列问题:
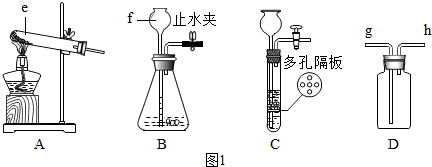
(1)图中e、f仪器的名称:e ,f .
(2)用氯酸钾和二氧化锰制氧气,选用发生装置 (填字母A、B、C、D),反应化学方程式是 .反应基本类型为 反应.
(3)关闭B装置中的止水夹后,从长颈漏斗向锥形瓶中注入一定量的水,静止后如图所示,则B装置 (填“漏气”、“不漏气”或“无法确定”).
(4)常温下用块状固体和液体反应制气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是 (选填下列说法的序号).
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
观察图C装置,制气体反应处于 (填“进行”或“停止”)中.
(5)实验室用双氧水和二氧化锰粉末制氧气的化学反应方程式为 ,该实验 (填“需要”或“不需要”)选用C装置.若用D装置来收集生成的氧气,气体应从 (填g或h)通入.
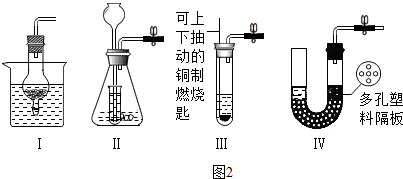
(6)用锌粒和稀硫酸制取氢气,如图2所示装置与C装置控制反应的原理一样的是 (填序号)
【拓展探究一】探究影响锌与稀硫酸反应快慢的因素.反应过程中,用收集50mL氢气的时间比较反应的快慢.控制其他条件相同,进行下表四组实验,实验装置及获得数据如表:
(7)实验中,图3中混合Y型管中稀硫酸与锌粒的操作方法是 ;
(8)比较实验a和实验b,可以得到的结论是 .
(9)为了研究硫酸浓度对反应快慢的影响,需比较实验 和实验 (填编号).
【拓展探究二】利用锌与稀硫酸的反应测定粗锌中锌的质量分数(杂质不溶于水、不与酸反应,生成气体完全逸出),如图4所示.

(10)根据质量守恒定律,反应生成氢气的质量为 ;
(11)154.3g滤液中的溶质为 ;
(12)求粗锌中锌的质量分数 .

(1)图中e、f仪器的名称:e
(2)用氯酸钾和二氧化锰制氧气,选用发生装置
(3)关闭B装置中的止水夹后,从长颈漏斗向锥形瓶中注入一定量的水,静止后如图所示,则B装置
(4)常温下用块状固体和液体反应制气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
观察图C装置,制气体反应处于
(5)实验室用双氧水和二氧化锰粉末制氧气的化学反应方程式为
(6)用锌粒和稀硫酸制取氢气,如图2所示装置与C装置控制反应的原理一样的是

【拓展探究一】探究影响锌与稀硫酸反应快慢的因素.反应过程中,用收集50mL氢气的时间比较反应的快慢.控制其他条件相同,进行下表四组实验,实验装置及获得数据如表:
| 实验编号 | 试剂 | 产生50mL氢气的 时间(s) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30 mL 30% | 52 |
| b | 含杂质的锌 | 30 mL 30% | 47 |
| c | 纯锌 | 30 mL 20% | 68 |
| d | 纯锌 | 40 mL 30% | 50 |
(8)比较实验a和实验b,可以得到的结论是
(9)为了研究硫酸浓度对反应快慢的影响,需比较实验
【拓展探究二】利用锌与稀硫酸的反应测定粗锌中锌的质量分数(杂质不溶于水、不与酸反应,生成气体完全逸出),如图4所示.

(10)根据质量守恒定律,反应生成氢气的质量为
(11)154.3g滤液中的溶质为
(12)求粗锌中锌的质量分数
考点:常用气体的发生装置和收集装置与选取方法,影响化学反应速率的因素探究,实验室制取氧气的反应原理,氢气的制取和检验,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见气体的实验室制法、检验、干燥与净化,科学探究
分析:(1)依据实验室常用仪器的认识解决此题;
(2)利用氯酸钾和二氧化锰制氧气是固体加热装置选择,正确写出化学方程式并根据化学反应类型判断;
(3)根据图中信息解答;
(4)用块状固体和液体反应常温下制气体时,C装置可以控制反应发生与停止;
(5)双氧水和二氧化锰粉末制氧气,二氧化锰是催化剂并且是粉末,不需要C装置,D用排水法收集气体,用其收集密度比空气大的气体则要长进短出,若用其收集密度比空气小的气体则要短进长出;
(6)用锌粒和稀硫酸制取氢气属于固液常温型,可以控制反应发生与停止;
(7)Y型管中稀硫酸与锌粒的操作方法是倾斜Y型管;
(8)根据表中信息解答;
(9)研究硫酸浓度对反应快慢的影响,应选择同一种纯锌;
(10)(11)根据表中信息解答;
(12)利用题中所给条件用化学方程式计算;
(2)利用氯酸钾和二氧化锰制氧气是固体加热装置选择,正确写出化学方程式并根据化学反应类型判断;
(3)根据图中信息解答;
(4)用块状固体和液体反应常温下制气体时,C装置可以控制反应发生与停止;
(5)双氧水和二氧化锰粉末制氧气,二氧化锰是催化剂并且是粉末,不需要C装置,D用排水法收集气体,用其收集密度比空气大的气体则要长进短出,若用其收集密度比空气小的气体则要短进长出;
(6)用锌粒和稀硫酸制取氢气属于固液常温型,可以控制反应发生与停止;
(7)Y型管中稀硫酸与锌粒的操作方法是倾斜Y型管;
(8)根据表中信息解答;
(9)研究硫酸浓度对反应快慢的影响,应选择同一种纯锌;
(10)(11)根据表中信息解答;
(12)利用题中所给条件用化学方程式计算;
解答:解:
(1)依据实验室常用仪器可知试管 长颈漏斗;
(2)氯酸钾和二氧化锰制氧气是固体加热装置选择发生装置A,化学方程式是2KClO3
2KCl+3O2↑,它是一种物质生成两种或两种以上其他物质的反应,故是分解反应;
(3)有图看出长颈漏斗内出现一段水柱,说明B装置不漏气;
(4)用块状固体和液体反应常温下制气体时,改用C装置可以控制反应发生与停止;
(5)双氧水和二氧化锰粉末制氧气,二氧化锰是催化剂并且是粉末,不需要C装置,D用排水法收集气体,用其收集密度比空气大的气体则要长进短出,若用其收集密度比空气小的气体则要短进长出,故气体应从g通入;
(6)用锌粒和稀硫酸制取氢气属于固液常温型,Ⅰ和Ⅳ装置内气压改变时,固体和液体分离,可以控制反应发生与停止;
(7)混合Y型管中稀硫酸与锌粒需用倾斜Y型管;
(8)根据表中信息可知,含杂质的锌和纯锌与不同体积和浓度的稀硫酸反应,纯锌所用时间长,故含杂质的锌反应比纯锌快;
(9)研究硫酸浓度对反应快慢的影响,应选择同一种纯锌,不同浓度的浓硫酸,表中ac符合;
(10)有图四知9.3g粗锌放入98g稀硫酸中得到107.1溶液,再加50g稀硫酸物气泡产生,说明锌完全消耗,生成硫酸锌和氢气,故氢气质量为9.3g+98g-107.1=0.2g;
(11)由于50g稀硫酸没有参加反应,故154.3g滤液中的溶质为硫酸锌和硫酸;
(12)解:设9.3g粗锌中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
=
x=6.5g
锌的质量分数=
×100%=69.9%
答案:
(1)试管 长颈漏斗
(2)A 2KClO3
2KCl+3O2↑ 分解反应
(3)不漏气
(4)C 进行
(5)2H2O2
2H2O+O2↑ 不需要 g
(6)Ⅰ和Ⅳ
(7)倾斜Y型管
(8)含杂质的锌反应比纯锌快
(9)a c
(10)0.2g
(11)硫酸锌和硫酸
(12)69.9%
(1)依据实验室常用仪器可知试管 长颈漏斗;
(2)氯酸钾和二氧化锰制氧气是固体加热装置选择发生装置A,化学方程式是2KClO3
| ||
| △ |
(3)有图看出长颈漏斗内出现一段水柱,说明B装置不漏气;
(4)用块状固体和液体反应常温下制气体时,改用C装置可以控制反应发生与停止;
(5)双氧水和二氧化锰粉末制氧气,二氧化锰是催化剂并且是粉末,不需要C装置,D用排水法收集气体,用其收集密度比空气大的气体则要长进短出,若用其收集密度比空气小的气体则要短进长出,故气体应从g通入;
(6)用锌粒和稀硫酸制取氢气属于固液常温型,Ⅰ和Ⅳ装置内气压改变时,固体和液体分离,可以控制反应发生与停止;
(7)混合Y型管中稀硫酸与锌粒需用倾斜Y型管;
(8)根据表中信息可知,含杂质的锌和纯锌与不同体积和浓度的稀硫酸反应,纯锌所用时间长,故含杂质的锌反应比纯锌快;
(9)研究硫酸浓度对反应快慢的影响,应选择同一种纯锌,不同浓度的浓硫酸,表中ac符合;
(10)有图四知9.3g粗锌放入98g稀硫酸中得到107.1溶液,再加50g稀硫酸物气泡产生,说明锌完全消耗,生成硫酸锌和氢气,故氢气质量为9.3g+98g-107.1=0.2g;
(11)由于50g稀硫酸没有参加反应,故154.3g滤液中的溶质为硫酸锌和硫酸;
(12)解:设9.3g粗锌中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
| 65 |
| x |
| 2 |
| 0.2g |
x=6.5g
锌的质量分数=
| 6.5g |
| 9.3g |
答案:
(1)试管 长颈漏斗
(2)A 2KClO3
| ||
| △ |
(3)不漏气
(4)C 进行
(5)2H2O2
| ||
(6)Ⅰ和Ⅳ
(7)倾斜Y型管
(8)含杂质的锌反应比纯锌快
(9)a c
(10)0.2g
(11)硫酸锌和硫酸
(12)69.9%
点评:本题尽管考查的知识内容不难,但由于考查的方式由整体选择变成化整为零地组合,需要对实验十分熟悉,没有经验是做不好的,另外本题最后一问的收集方法很特殊,一定要把原理搞懂,需要打破常规思维.

练习册系列答案
相关题目
下列实验操作正确的是( )
A、 熄灭酒精灯 |
B、 倾倒液体 |
C、 称量 |
D、 液体过滤 |
下列实验方案不可行的是( )
| A、用蒸馏法制取蒸馏水 |
| B、用肥皂水区分硬水和软水 |
| C、用燃着的木条区别CO2和O2 |
| D、用称取煮沸前后蒸馏水的方法来验证质量守恒定律 |
下列图象表示的内容不正确的是( )
A、 向一定量的大理石中加入足量稀盐酸 |
B、 将1g二氧化锰添加到2.45g氨酸钾中加热制取氧气 |
C、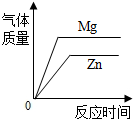 将粗细、形状、质量相同的镁、锌分别投入两份足量的完全相同的稀盐酸中 |
D、 将1g硫酸钠加入一定量的水中做电解水实验 |
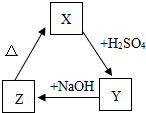 X、Y、Z之间存在如图转化关系:
X、Y、Z之间存在如图转化关系: