题目内容
取10.0g碳酸钙高温加热,一段时间后停止加热,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )
| A、生成2.0g CO2气体 |
| B、剩余固体的质量为5.0g |
| C、生成了5.6g CaO |
| D、剩余CaCO3的质量为8.0g |
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:据化学变化前后元素质量不变,可得反应前后固体物质中钙元素的质量相等,由反应前碳酸钙中所含量钙元素的质量及反应后固体中钙元素的质量分数可计算反应后所得固体的质量,然后使用质量守恒定律,反应前后固体的质量差即为分解过程放出二氧化碳气体的质量.
解答:解:原碳酸钙10g中的钙元素质量为:10g×
×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=
=8g
根据质量守恒定律,反应生成二氧化碳的质量=10g-8g=2g
生成的氧化钙质量是x
CaCO3
CaO+CO2↑
56 44
x 2.0g
=
x=2.56g
分析选项可知A正确,其余均错误;
分析所给的选项可以知道选项B是正确的.
故选:A.
| 40 |
| 40+12+16×3 |
| 4g |
| 50% |
根据质量守恒定律,反应生成二氧化碳的质量=10g-8g=2g
生成的氧化钙质量是x
CaCO3
| ||
56 44
x 2.0g
| 56 |
| x |
| 44 |
| 2.0g |
x=2.56g
分析选项可知A正确,其余均错误;
分析所给的选项可以知道选项B是正确的.
故选:A.
点评:本题考查了对质量守恒定律的理解与应用,依据元素在反应前后质量不会变化,对于解答本题尤为重要.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
化学实验操作直接影响实验结果和人身安全.下列说法正确的是( )
| A、为了节约药品,用剩的药品应当放回原试剂瓶中 |
| B、用100mL的量筒量取8.5mL的水 |
| C、用托盘天平称取食盐5.85g |
| D、熄灭酒精灯要用灯帽盖灭 |
6月7日,第九届国际二氧化碳大会在京落幕,来自世界各国的400多位与生态及环境领域的专家参加了此次会议,共同探讨全球碳循环过程及二氧化碳减排机制.下列关于空气中二氧化碳的说法正确的是( )
| A、在通常情况下,二氧化碳是一种无色、无味的气体 |
| B、植树造林会造成二氧化碳含量升高 |
| C、二氧化碳在日常生活中应用广泛,所以空气中越多越好 |
| D、二氧化碳不支持呼吸,所以空气中含量越少越好 |
下列实验方案不可行的是( )
| A、用蒸馏法制取蒸馏水 |
| B、用肥皂水区分硬水和软水 |
| C、用燃着的木条区别CO2和O2 |
| D、用称取煮沸前后蒸馏水的方法来验证质量守恒定律 |
炭和碳酸钙的混和物在空气中强热后,碳酸钙完全分解,碳被完全氧化,若生成的二氧化碳的质量与混和物的质量相同,则原混和物中的碳的质量分数为( )
| A、27.27% |
| B、34.7% |
| C、65.3% |
| D、82.65% |
下列图象表示的内容不正确的是( )
A、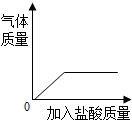 向一定量的大理石中加入足量稀盐酸 |
B、 将1g二氧化锰添加到2.45g氨酸钾中加热制取氧气 |
C、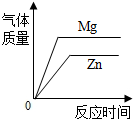 将粗细、形状、质量相同的镁、锌分别投入两份足量的完全相同的稀盐酸中 |
D、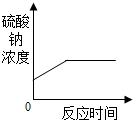 将1g硫酸钠加入一定量的水中做电解水实验 |
下列物质在氧气中燃烧,能产生白色固体的是( )
| A、铁丝 | B、红磷 | C、木炭 | D、硫粉 |
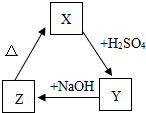 X、Y、Z之间存在如图转化关系:
X、Y、Z之间存在如图转化关系: