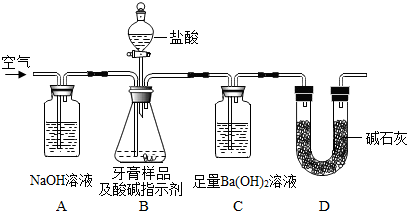
题目内容
6.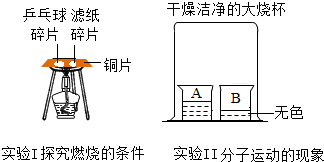 “控制变量”是进行对比实验的重要手段.某同学在学完相关的化学知识后,走进实验室做了如下含有对比思想的化学实验,请你参与并回答下列问题.
“控制变量”是进行对比实验的重要手段.某同学在学完相关的化学知识后,走进实验室做了如下含有对比思想的化学实验,请你参与并回答下列问题.(1)根据实验Ⅰ的目的,主要对比出乒乓球碎片和滤纸碎片的着火点不同.
(2)实验Ⅱ的烧杯B中呈现的现象能说明分子是不断运动的.当烧杯A中液体是浓氨水时,烧杯B中的酚酞溶液由无色变为红色;当烧杯A中液体换成足量浓盐酸,且烧杯B中液体换成滴有少量石灰水的酚酞溶液时,一段时间后,溶液颜色的变化是由红色变成无色,此时引起溶液颜色改变反应的化学方程式为2HCl+Ca(OH)2=CaCl2+2H2O.
分析 (1)根据燃烧的条件进行解答;
(2)根据浓盐酸、浓氨水具有挥发性以及酸碱指示剂遇到酸碱变色情况进行解答.
解答 解:(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,实验A中滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,利用铜片的导热性,在中间加热,能够提供均匀的热量,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点;
(3)实验的烧杯B中呈现的现象能说明分子是不断运动的.当烧杯A中液体时浓氨水时,浓氨水具有挥发性,挥发出的氨气溶于水显碱性,所以烧杯B中的酚酞溶液由无色变为红色;当烧杯A中液体换成浓盐酸,浓盐酸具有挥发性,挥发出的氯化氢气体溶于水显酸性,烧杯B中液体换成滴有酚酞石灰水时,一段时间后,盐酸与氢氧化钙反应,溶液颜色的变化是红色逐渐褪去变为无色,方程式为 2HCl+Ca(OH)2=CaCl2+2H2O;
故答案为:(1)着火点.
(2)红; 由红色变成无色; 2HCl+Ca(OH)2=CaCl2+2H2O.
点评 此题是一道综合性的实验设计题,解题的关键是掌握燃烧的条件、二氧化碳的性质、微粒的性质并进行知识的大胆迁移,只有这样才能顺利解题.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
17.下列实验操作中不正确的是( )
| A. |  熄灭酒精灯 | B. |  酸碱中和反应 | ||
| C. |  蒸发食盐水 | D. |  称量氢氧化钠固体 |
11.有关酸碱盐的知识下列说法正确的是( )
| A. | 稀硫酸和氧化铁反应的反应类型属于置换反应 | |
| B. | 100g10%NaOH溶液与100g10%的盐酸充分反应后,溶液呈中性 | |
| C. | 检验自来水中是否含有Cl-时,先加入硝酸银溶液,再加入稀硝酸,如果有白色沉淀出现,则证明溶液中有Cl- | |
| D. | 在农村,人们常取少量化肥和消石灰一起放在手掌心搓,通过闻气味的方法来检验是否是氮肥,因为铵盐和碱反应后有二氧化碳气体生成 |
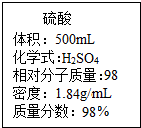 实验室有一瓶浓硫酸,瓶上标签如图,请根据标签上提供的数据解答下列问题.
实验室有一瓶浓硫酸,瓶上标签如图,请根据标签上提供的数据解答下列问题.