题目内容
15. 小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:
小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:【提出问题】猜想Ⅰ:铜与浓硫酸不能反应;
猜想Ⅱ:铜与浓硫酸能反应,且可能生成氢气.
【实验探究】实验Ⅰ:在一支试管中加入一小片铜,再加入少量的浓硫酸,放置一段时间,试管中无现象;
实验Ⅱ:再给上述试管加热,试管中产生有刺激性气味的气体,将反应后的溶液小心地注入到盛有少量水的烧杯中,溶液呈现出明显的蓝色.
【分析猜想】(1)溶液呈蓝色,说明生成了CuSO4(硫酸铜)
(2)根据实验现象及已有的知识推断,产生的气体不可能是氢气,很可能是一种含硫元素的气体.
【查阅资料】(1)常见的含硫元素的气体有二氧化硫和硫化氢.
(2)二氧化硫密度比空气大,常温下,1体积水溶解40体积二氧化硫;二氧化硫和二氧化碳化学性质相似
(3)二氧化硫能使品红溶液褪色,加热,又能恢复原来的红色.硫化氢不能使品红溶液褪色.
(4)二氧化硫和硫化氢均有毒.
【实验探究】为了检验产生的有刺激性气味的气体的成分,小红和她的同学进一步实验:将产生的气体通入品红溶液中,品红溶液褪色,加热,溶液又恢复了红色.
【实验结论】(1)在常温下,铜与浓硫酸不能反应
(2)在加热条件下铜与浓硫酸反应产生的气体是SO2(二氧化硫),此反应还生成了水,请写出该反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)浓硫酸与铜加热时能反应,而稀硫酸与铜即使加热也不能反应,由此说明:物质的化学性质除了与物质本身的性质有关外,还可能与溶液中溶质的浓度大小或质量分数大小有关.
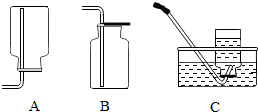
【拓展延伸】(1)收集二氧化硫的装置是B.
(2)为了防止污染空气,请你设计一套方案吸收多余的气体.将产生的气体通入NaOH溶液中.
分析 【分析猜想】根据已有的知识进行分析,硫酸铜的水溶液呈蓝色;
【实验结论】(2)根据题干信息可知,品红溶液褪色说明有二氧化硫生成,根据化学方程式的书写方法和原则来分析解答;
(3)两组实验的区别在反应物中硫酸的浓度不同,因此出现了不同的实验现象;
【拓展延伸】根据二氧化硫的密度和溶解性来分析;
二氧化硫能与氢氧化钠反应生成亚硫酸钠和水,所以可用氢氧化钠溶液来进行吸收.
解答 解:【分析猜想】(1)由已知所学知识可知,溶液的颜色为蓝色,说明其中含有铜离子,因为是浓硫酸与铜的反应,且溶液变蓝,说明有硫酸铜生成,故填:CuSO4(硫酸铜);
【实验结论】(2)该气体能使品红溶液褪色说明有二氧化硫生成,铜能与浓硫酸在加热时反应生成硫酸铜、二氧化硫和水,故填:SO2(二氧化硫),Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)铜不能与稀硫酸反应,可以与浓硫酸反应,说明化学反应与反应物的浓度有关,故填:浓度大小或质量分数大小;
【拓展延伸】(1)因为二氧化硫的密度比空气大,且能溶于水,故只能用向上排空气法来收集;故填:B;
(2)因为二氧化硫能与氢氧化钠反应生成亚硫酸钠和水,所以多余的二氧化硫气体可用氢氧化钠溶液来进行吸收,故填:将产生的气体通入NaOH溶液中.
点评 本题为科学探究题,完成此题,可以依据题干提供的信息结合物质的性质进行.

练习册系列答案
相关题目
6.下列四个图象反映了对应实验过程中相关量的变化,其中不正确的是( )
| A. |  向一定量因长期存放而变质的NaOH溶液中滴加澄清石灰水 向一定量因长期存放而变质的NaOH溶液中滴加澄清石灰水 | |
| B. |  O2的溶解度受温度影响的变化曲线 O2的溶解度受温度影响的变化曲线 | |
| C. |  等质量的Mg粉和Fe粉与足量同浓度的稀硫酸反应 等质量的Mg粉和Fe粉与足量同浓度的稀硫酸反应 | |
| D. |  硫酸溶液稀释过程中pH的变化曲线 硫酸溶液稀释过程中pH的变化曲线 |
3.在托盘天平两边各放一个盛有足量稀硫酸的烧杯,把天平调节至平衡,然后在两边的烧杯中再各加入下列物质,充分反应后天平仍保持平衡的是( )
①10克铁和10克锌 ②10克铁和10克氧化铁 ③10克碳酸钙和5.6克氧化钙
④5.6克铁和6.5克锌 ⑤10克铜和10克氧化铜 ⑥6.5克锌和6.3克氧化锌.
①10克铁和10克锌 ②10克铁和10克氧化铁 ③10克碳酸钙和5.6克氧化钙
④5.6克铁和6.5克锌 ⑤10克铜和10克氧化铜 ⑥6.5克锌和6.3克氧化锌.
| A. | ①②③ | B. | ③④⑥ | C. | ①②④ | D. | ③⑤⑥ |
10.下列各种说法中,满足质量守恒定律的是( )
| A. | 硫酸铜溶液与氢氧化钠溶液反应前后溶液的总质量不变 | |
| B. | 氢氧化钠溶液与稀盐酸反应前后溶液中的溶质总质量减少了 | |
| C. | 一氧化碳还原氧化铜的反应前后固体总质量不变 | |
| D. | 硫酸与碳酸钠溶液反应前后溶液中的溶剂总质量不变 |
7.下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子序号是( )


| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
4.工业上以CaO和HNO3为原料制备Ca(NO3)2•4H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为[CaO和HNO3反应的化学方程式为CaO+2HNO3═Ca(NO3)2+H2O]( )
| A. | 30% | B. | 70% | C. | 63% | D. | 无法计算 |
5.为了探究溶质在水中溶解速率的影响因素,某学习小组设计了如下实验:下列说法中正确的是( )


| A. | 对比实验①和②,可探究水的温度对溶质在水中溶解速率的影响 | |
| B. | 对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响 | |
| C. | 对比实验②和③,可探究固体溶质的颗粒大小对溶质在水中溶解速率的影响 | |
| D. | 对比实验①和③,可探究固体溶质的颗粒大小对溶质在水中溶解速率的影响 |
