题目内容
6.工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰.有关反应化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑(1)某工厂用6吨含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是4.5吨.
(2)上述石灰石理论上可以制得生石灰多少吨?
分析 (1)根据石灰石的质量、碳酸钙的质量分数可以计算碳酸钙的质量;
(2)根据碳酸钙的质量可以计算生成氧化钙的质量即可.
解答 解:(1)该石灰石所含碳酸钙质量为:6t×75%=4.5t;故填:4.5;
(2)设生成氧化钙的质量为x,
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56
4.5t x
$\frac{100}{4.5t}=\frac{56}{x}$
x=2.52t
答:能生产出生石灰2.52t.
点评 本题主要考查学生运用化学方程式进行计算的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
10. 某反应前后分子变化的微观示意图如下,下列说法正确的是( )
某反应前后分子变化的微观示意图如下,下列说法正确的是( )
 某反应前后分子变化的微观示意图如下,下列说法正确的是( )
某反应前后分子变化的微观示意图如下,下列说法正确的是( )| A. | 反应物与生成物共有5种物质 | B. | 反应后原子的个数增多 | ||
| C. | 该图可示意SO2与O2的反应 | D. | 该反应属于分解反应 |
14.同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2 CO3溶液反应后溶液中溶质的成分进行探究.请你一同探究并回答下列问题:
【提出问题】滤液中的溶质是什么物质?
【查阅资料】①Ca(NO3)2溶液呈中性. ②Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3
【猜想假设】甲同学认为只含有NaOH;乙同学认为只含有NaOH,Ca(OH)2;丙同学认为含有NaOH、Ca(OH)2、Na2CO3;你认为可能含有NaOH和Na2CO3
【分析讨论】丁同学认为丙同学的猜想肯定是不合理的,理由是如果氢氧化钙和碳酸钠同时存在时会发生化学反应.
【实验设计】请你设计一个简单的实验来验证你的猜想是正确的.
甲同学也针对自己的猜想进行了如下实验.
你认为甲同学的实验结论是否正确?不正确(填“正确”或“不正确”),理由是如果含有NaOH和Ca(OH)2时或含有NaOH和Na2CO3时,滴加少量的稀盐酸时也是无明显现象.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
【提出问题】滤液中的溶质是什么物质?
【查阅资料】①Ca(NO3)2溶液呈中性. ②Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3
【猜想假设】甲同学认为只含有NaOH;乙同学认为只含有NaOH,Ca(OH)2;丙同学认为含有NaOH、Ca(OH)2、Na2CO3;你认为可能含有NaOH和Na2CO3
【分析讨论】丁同学认为丙同学的猜想肯定是不合理的,理由是如果氢氧化钙和碳酸钠同时存在时会发生化学反应.
【实验设计】请你设计一个简单的实验来验证你的猜想是正确的.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中, 滴加足量的硝酸钙溶液,再滴入几滴酚酞试液 | 出现白色沉淀,酚酞试液变红色 | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
1.物质甲和乙完全燃烧生成物质丙和丁,各物质的微观示意图如表所示.
下列说法错误的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |  |
| 分子示意图 |  |  |  |  |
| A. | 甲物质属于有机物 | |
| B. | 该反应属于置换反应 | |
| C. | 反应后元素的种类不变 | |
| D. | 该反应的化学方程式为:C2H4+302 $\frac{\underline{\;点燃\;}}{\;}$2C02+2H20 |
18. 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
【数据分析】
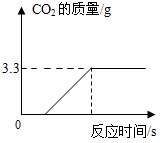
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
| 实验操作步骤 | 实验现象 |
| (1)取样,滴加足量稀盐酸 (2)另取适量的样品,加足量的水溶解,静置取上层清液,滴加酚酞试液 | (1)产生大量的气泡 (2)溶液呈红色 |
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
15.“垃圾是放错位置的资源”,下列垃圾分类不合理的是( )
| A. | 可回收垃圾:易拉罐 | B. | 不可回收垃圾:废报纸 | ||
| C. | 有害垃圾:废旧电池 | D. | 餐厨垃圾:剩余饭菜 |