题目内容
16.下列实验操作不正确的是( )| A. |  取用锌粒 | B. |  加热液体 | ||
| C. |  检查装置气密性 | D. |  玻璃管套上橡皮管 |
分析 A、根据取用块状固体的正确方法分析;
B、根据加热液体药品的注意事项分析;
C、根据检查装置气密性的正确方法分析;
D、左手拿橡皮塞,右手拿玻璃管,玻璃管用水沾一下,轻轻地旋上.
解答 解:A、加入固体药品时要注意“一斜二送三直立”,图中操作容易砸破试管,故错误;
B、试管中的液体加热时试管夹要夹在试管的中上部、试管中的液体取用量不能超过试管容积的三分之一、试管口不能朝着有人的地方、试管与桌面呈45度角,故正确;
C、导管放入水中,用手握住试管,导管口有气泡冒出,装置气密性良好,操作正确,故正确;
D、连接时要注意安全,防止玻璃管破裂,扎伤手.图中操作正确.
故选A.
点评 本题主要考查实验操作的注意事项:掌握检验装置气密性的方法,以及固体的取用方法和加热液体的方法.

练习册系列答案
相关题目
19.二氧化氮(NO2)是造成酸雨的一种气体,其中氮元素的化合价是( )
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
7.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图.每2分钟测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并记录前18分钟数据如表.(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)
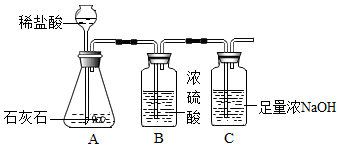
(1)B装置的作用是吸收水分,干燥气体.
(2)本实验测量石灰石中CaCO3的质量分数比实际石灰石中CaCO3的质量分数小.试分析可能原因是反应装置中生成的二氧化碳没有全部被排出.
(3)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:2.40g,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同..

| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
(2)本实验测量石灰石中CaCO3的质量分数比实际石灰石中CaCO3的质量分数小.试分析可能原因是反应装置中生成的二氧化碳没有全部被排出.
(3)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:2.40g,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同..
4.某原子的结构示意图为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该原子属于非金属元素的原子 | B. | 该原子形成离子后电子层数不变 | ||
| C. | 该原子的核外电子数为1 | D. | 该原子在化学反应中易失去电子 |
1. 如图是电解水实验的装置图,下列叙述正确的是( )
如图是电解水实验的装置图,下列叙述正确的是( )
 如图是电解水实验的装置图,下列叙述正确的是( )
如图是电解水实验的装置图,下列叙述正确的是( )| A. | 实验说明水是由氢分子和氧原子构成的 | |
| B. | 乙试管内产生的气体能使带火星的木条复燃 | |
| C. | 电解水的文字表达式为:水$\stackrel{通电}{→}$氢气+氧气 | |
| D. | 甲、乙两试管产生的气体质量之比为1:2 |
8.现甲、乙两化学小组安装两套如图1装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素
(1)下列方法能检查该装置气密性的是AB
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下下H2O2分解的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)甲小组有如下实验设计方案,完成如表.
(4)甲、乙两小组得出如图2数据
甲组实验得出的数据可知:浓度越大,H2O2分解速率越快;
由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用BaO2固体与硫酸溶液反应制H2O2(已知还生成硫酸钡沉淀),其化学反应方程式为BaO2+H2SO4=BaSO4↓+H2O2
支持这一方案的理由是过氧化氢在酸性环境下分解较慢

(1)下列方法能检查该装置气密性的是AB
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下下H2O2分解的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)甲小组有如下实验设计方案,完成如表.
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
甲组实验得出的数据可知:浓度越大,H2O2分解速率越快;
由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用BaO2固体与硫酸溶液反应制H2O2(已知还生成硫酸钡沉淀),其化学反应方程式为BaO2+H2SO4=BaSO4↓+H2O2
支持这一方案的理由是过氧化氢在酸性环境下分解较慢

5.下列说法错误的是( )
| A. | 地球上水量丰富,水资源是取之不尽用之不竭的 | |
| B. | 过滤可以除去水中不溶性的固体杂质 | |
| C. | 净化水的操作中,净化程度最高的是蒸馏 | |
| D. | 向水中加入吸附剂(如活性炭等)可以除去水中的部分杂质,但不能降低水的硬度 |
 如图(甲)是A、B、C 种固体物质的溶解度曲线,回答下列问题:
如图(甲)是A、B、C 种固体物质的溶解度曲线,回答下列问题: