题目内容
7.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图.每2分钟测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并记录前18分钟数据如表.(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)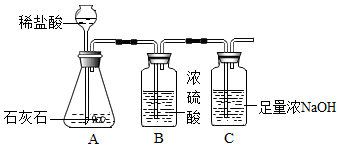
| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
(2)本实验测量石灰石中CaCO3的质量分数比实际石灰石中CaCO3的质量分数小.试分析可能原因是反应装置中生成的二氧化碳没有全部被排出.
(3)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:2.40g,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同..
分析 (1)浓硫酸具有吸水性;
(2)根据装置C和氢氧化钠的性质解答;
(3)根据块状大理石和大理石碎屑的成分、质量相同解答.
解答 解:(1)浓硫酸具有吸水性,装置B的作用是吸收气体中的水分,干燥气体;故答案为:吸收水分,干燥气体;
(2)反应装置中生成的二氧化碳没有全部被排出,使得纯度偏小,故答案为:反应装置中生成的二氧化碳没有全部被排出.
(3)根据表格可以看出,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同,故块状大理石与稀盐酸反应最多能生成2.40gCO2,故答案为:2.40g,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同.
点评 本题难度较大,明确实验基本原理及会分析图象方能正确解决本题.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
15.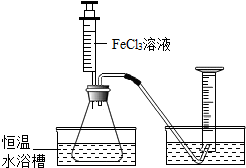 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
【定性探究】分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,可通过观察产生气泡的快慢来定性比较两者的反应速率.
【定量探究】为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计.如图所示.
【方案一】在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
【方案二】在不同过氧化氢浓度下,测定相同时间收集气体体积的多少.
方案二的实验测量结果:
表中x=3,y=5.
实验结论:通过测量,若V1>V2(填“>”、“=”或“<”),说明在其他条件相同的情况下过氧化氢溶液浓度越大反应速率越快.
 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.【定性探究】分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,可通过观察产生气泡的快慢来定性比较两者的反应速率.
【定量探究】为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计.如图所示.
【方案一】在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
【方案二】在不同过氧化氢浓度下,测定相同时间收集气体体积的多少.
方案二的实验测量结果:
| 序号 | H2O2溶液的体积/mL | H2O2溶液的浓度/% | 2%FeCl3溶液的体积/mL | 反应的时间/min | 生成O2的体积m/L |
| 1 | 10 | 30 | x | 5 | V1 |
| 2 | 10 | 15 | 3 | y | V2 |
实验结论:通过测量,若V1>V2(填“>”、“=”或“<”),说明在其他条件相同的情况下过氧化氢溶液浓度越大反应速率越快.
2.在高温下,铁与水蒸气能发生反应生成一种常见铁的氧化物和一种气体,某化学 学习小组的同学对此反应甩感兴趣,在小组集体协作下设计了如下实验,以探究铁粉与水蒸气反应后的产物,也邀请你一起来完成下列探究: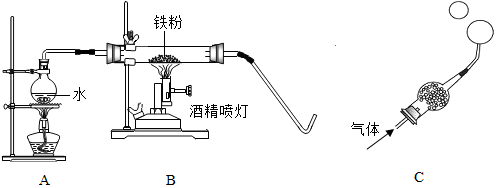
(1)A装置的作用四产生水蒸气;
(2)探究生成的气体是什么?
【猜想与假设】猜想一:生成的气体可能是氢气;
猜想二:生成的气体可能是氧气;
【实验探究】将生成的气体通入C装置,球形管里装有碱石灰干燥剂,导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡,当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
【推断】生成的气体是氢气.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe和Fe3O4;
猜想二:剩余固体是:Fe3O4.
【实验探究】
[实检结论]铁与水蒸气反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
【反思与交流】该黑色固体不可能是FeO、Fe2O3,理由是FeO、Fe2O3都不能被磁铁吸引,氧化铁是红棕色粉末.

(1)A装置的作用四产生水蒸气;
(2)探究生成的气体是什么?
【猜想与假设】猜想一:生成的气体可能是氢气;
猜想二:生成的气体可能是氧气;
【实验探究】将生成的气体通入C装置,球形管里装有碱石灰干燥剂,导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡,当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
【推断】生成的气体是氢气.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被进磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
【猜想与假设】猜想一:剩余固体是Fe和Fe3O4;
猜想二:剩余固体是:Fe3O4.
【实验探究】
| 实验操作 | 实验现象及结论 |
【反思与交流】该黑色固体不可能是FeO、Fe2O3,理由是FeO、Fe2O3都不能被磁铁吸引,氧化铁是红棕色粉末.
12. 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
(1)对二氧化锰在过氧化氢分解反应中的作用,下列分析正确的是B.
A.二氧化锰能使过氧化氢分解产生的氧气总质量增加
B.二氧化锰能使过氧化氢分解速度变大,但是产生氧气总质量不变
C.二氧化锰能使过氧化氢分解速度变大,产生的氧气总质量变大
(2)研究催化剂的某些因素对过氧化氢分解速率的影响
实验一:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).
测定数据如下表所示:
①加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,该步操作的实验目的是控制催化剂中金属离子的数量相同,对比它们种类对过氧化氢分解的速率影响.
②根据上表数据得出的结论是铁离子对过氧化氢的催化效果强于铜离子.
实验二:从一块土豆的同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,将两份土豆同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.观察到两量筒内均有气泡生成,一段时间后,只有土豆片不断上升,而土豆块不能上浮.通过实验得出的结论是反应物和催化剂的接触面积越大,反应速率越快.
 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.(1)对二氧化锰在过氧化氢分解反应中的作用,下列分析正确的是B.
A.二氧化锰能使过氧化氢分解产生的氧气总质量增加
B.二氧化锰能使过氧化氢分解速度变大,但是产生氧气总质量不变
C.二氧化锰能使过氧化氢分解速度变大,产生的氧气总质量变大
(2)研究催化剂的某些因素对过氧化氢分解速率的影响
实验一:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).
测定数据如下表所示:
| 时间/s 试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL 5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
②根据上表数据得出的结论是铁离子对过氧化氢的催化效果强于铜离子.
实验二:从一块土豆的同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,将两份土豆同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.观察到两量筒内均有气泡生成,一段时间后,只有土豆片不断上升,而土豆块不能上浮.通过实验得出的结论是反应物和催化剂的接触面积越大,反应速率越快.
19.将2.3g钠放入100g水中,所得溶液的质量分数是( )
| A. | 等于2.3% | B. | 等于4% | C. | 大于2.3%小于4% | D. | 大于4% |
16.下列实验操作不正确的是( )
| A. |  取用锌粒 | B. |  加热液体 | ||
| C. |  检查装置气密性 | D. |  玻璃管套上橡皮管 |

 是钠元素的原子结构示意图.该原子在化学反应中易失去电子(填“得到”或“失去”)它在化学反应中形成的离子与Ne(填元素符号)原子具有相同的核外电子排布;
是钠元素的原子结构示意图.该原子在化学反应中易失去电子(填“得到”或“失去”)它在化学反应中形成的离子与Ne(填元素符号)原子具有相同的核外电子排布;