题目内容
5.某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率.(1)提出问题:什么物质是该反应催化剂?
催化剂能改变化学反应的速率,而本身的质量和化学性质 都不改变
(2)猜想与假设:下面是组内两位同学所作的猜想,请你完成小华的猜想.
【假设一】小芳同学:锈铁钉表面的氧化铁是H2O2溶液分解反应的催化剂.
【假设二】小华同学:锈铁钉里的铁是H2O2溶液分解反应的催化剂.
(3)实验与结论:
| 实验操作 | 实验现象 | 实验结论 |
| 实验I:把一定质量的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象. | 产生大量气泡,带火星的木条复燃 | 假设一成立 |
| 实验Ⅱ:取10mL5%的过氧化氢溶液于另一支试管中,加入铁单质,并用一根带火星的小木条置于试管口,观察现象. | 无现象 | 假设二不成立(填“成立”或“不成立”) |
分析 此题涉及到“寻找新的催化剂”,将生锈的铁钉放到过氧化氢溶液中探究过氧化氢溶液的分解速率,通过(1)步提出的问题再利用(2)步的猜想与假设,经过(3)步的实验过程及现象得出结论,再经过(4)步的讨论交流,知氧化铁能做过氧化氢溶液的催化剂,而铁单质不能做其反应的催化剂.
解答 解:(1)能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后不变的物质叫做催化剂;故填:改变;质量;化学性质;
(2)生锈铁钉的组成主要是:氧化铁和铁,假设一:小芳同学:铁钉表面的“氧化铁”是H2O2溶液分解反应的催化剂;假设二:小华同学:铁钉里的“铁”是H2O2溶液分解反应的催化剂;故填:铁;
(3)
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一定质量的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象. | 产生大量气泡,带火星的木条复燃 | 假设一成立 |
| 实验Ⅱ:取10mL5%的过氧化氢溶液于另一支试管中,加入铁单质,并用一根带火星的小木条置于试管口,观察现象. | 无现象 | 假设二不成立 |
| 实验操作 | 实验现象 | 实验结论 |
| 产生大量气泡,带火星的木条复燃 | ||
| 铁单质 | 不成立 |
点评 本题的思路很明确,就是验证氧化铁对过氧化氢分解是否有催化作用,按照探究实验的步骤按部就班的完成.

练习册系列答案
相关题目
13.实验室加热2mL氢氧化钠溶液,需要使用的仪器是( )

| A. | ①②④⑤⑥ | B. | ①②④⑤⑦ | C. | ①③④⑤⑦ | D. | ③④⑤⑥⑧ |
14.水是生命活动的重要物质.下列有关水的变化,属于化学变化的是( )
| A. | 水电解 | B. | 水结冰 | C. | 水沸腾 | D. | 水蒸发 |
11.图1所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,p0是集气瓶内初始压强,p和p1分别是反应结束后恢复到室温时集气瓶内的压强.已知相同条件下集气瓶中气体的压强与气体所占的体积成正比).下列说法正确的是( )


| A. | 燃烧匙内所装红磷或木炭的多少对实验结果无影响 | |
| B. | 反应开始时集气瓶中压强瞬间变大均是由燃烧瞬间产生了大量气体引起的 | |
| C. | 图3中p1=p0是因为该实验装置漏气造成的 | |
| D. | 由图2 中p=0.79p0可推出空气中氧气的体积占总体积的21% |
15.下列属于化学变化的是( )
| A. | 冰雪融化 | B. | 粮食酿酒 | C. | 铁杵磨针 | D. | 汽油挥发 |
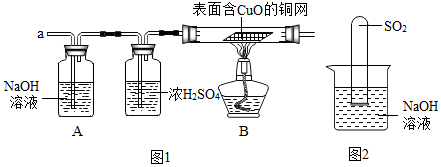
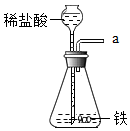 实验室中,操作不规范有极大的安全隐患.回答下列问题:
实验室中,操作不规范有极大的安全隐患.回答下列问题: