题目内容
8.实验室欲配制100g15%的食盐水,(1)计算:计算需食盐15g,水85毫升;
(2)称量:用托盘天平称取所需的氯化钠,(其中左物氯化钠)放入烧杯中.选用(“50mL”、“100mL”、“150mL”)100mL量筒量取所需的水;
(3)溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌.(搅拌的作用加速溶解)待氯化钠完全溶解时,15%的氯化钠溶液就配制好了.
分析 (1)配制溶液时,首先要计算配制时所需要的溶质和溶剂的量;溶质质量=溶液质量×溶液中溶质的质量分数;溶剂质量=溶液质量-溶质质量;
(2)根据计算结果,使用天平称取固体氯化钠,并倒入烧杯;
(3)使用量量筒量取水,倒入烧杯,用玻璃棒搅拌,加快固体氯化钠的溶解.
解答 解:(1)计算所需要溶质和溶剂的量:配制100g15%的食盐水需要氯化钠的质量=100g×15%=15g,
需要水的质量=100g-15g=85g(合85mL)
(2)称量,用托盘天平称取所需的氯化钠,(其中左物氯化钠)放入烧杯中.量取水并进行溶解,根据量程相近的原则,选用100mL量筒量取所需的水;
(3)溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌.(搅拌的作用加速溶解)待氯化钠完全溶解时,15%的氯化钠溶液就配制好了.
故答案为:
(1)15;85;
(2)氯化钠;100mL;
(3)加速溶解.
点评 熟悉溶质质量分数的计算公式,浓溶液配制稀溶液的计算方法等知识,就能正确解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.人类社会的发展需要充足的能源、丰富的材料、良好的环境.广阔的海洋中蕴含着无穷的资源,开发海洋,利用海洋成为人们关注的热点.利用粗盐,可以进一步获得纯碱.请你利用以下信息对相关问题进行研究.
【生产流程】
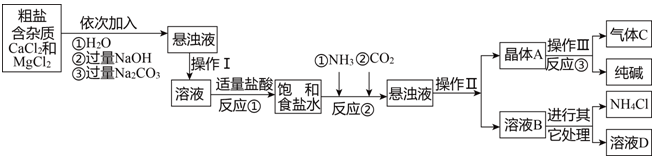
【产品与原理】
采用“侯氏制减法”生产工产品--纯碱和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【相关资料】
已知20℃时有关物质的溶解度如下(气体值1体积水中能溶解的气体体积)
【问题讨论】
(1)操作Ⅰ、Ⅱ中,相同操作的名称为过滤.
(2)反应①中发生了2个反应.
(3)写出溶液B中除了NH4Cl的另一种溶质是碳酸氢钠.
(4)上述产生流程中可循环使用的是A(填序号).
A.挥发性气体CB.溶液BC.氢氧化镁D.化肥NH4Cl.
【生产流程】

【产品与原理】
采用“侯氏制减法”生产工产品--纯碱和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【相关资料】
已知20℃时有关物质的溶解度如下(气体值1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
(1)操作Ⅰ、Ⅱ中,相同操作的名称为过滤.
(2)反应①中发生了2个反应.
(3)写出溶液B中除了NH4Cl的另一种溶质是碳酸氢钠.
(4)上述产生流程中可循环使用的是A(填序号).
A.挥发性气体CB.溶液BC.氢氧化镁D.化肥NH4Cl.
20.若把80℃的某硝酸钾饱和溶液冷却到50℃,下列说法中正确的是( )
| A. | 溶液的总质量保持不变 | B. | 溶液中溶剂的质量保持不变 | ||
| C. | 还能继续溶解硝酸钾晶体 | D. | 剩余溶液一定是不饱和溶液 |

