题目内容
10.把17.5g干燥纯净的氯酸钾和3.25g二氧化锰充分混合后装入大试管,给试管加热一段时间后终止反应,等试管冷却后,称量,得15.95g固体物质,求反应中制得的氧气多少克和氯酸钾分解的百分率?分析 氯酸钾在二氧化锰的催化作用作用下受热分解生成氯化钾和氧气,反应前后的质量差即为反应生成氧气的质量,根据生成氧气的质量可以计算反应的氯酸钾的质量,进一步可以计算氯酸钾分解的百分率.
解答 解:设反应的氯酸钾质量为x,
反应生成氧气的质量为:17.5g+3.25g-15.95g=4.8g,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
245 96
x 4.8g
$\frac{245}{x}$=$\frac{96}{4.8g}$,
x=12.25g,
氯酸钾分解的百分率为:$\frac{12.25g}{17.5g}$×100%=70%,
答:反应生成了4.8g氧气,氯酸钾分解的百分率是70%.
点评 因为反应只有氧气一种气体产生,因此反应前后的质量差就是反应生成氧气的质量,要注意理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ”表示氧原子,“
”表示氧原子,“ ”表示氢原子)
”表示氢原子)
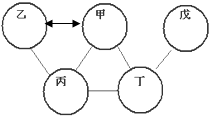 如图所示,其中甲、乙、丙、丁、戊分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种.两圆连线表示二者可以发生反应.已知甲和乙可以通过反应相互转化.请回答下列问题:
如图所示,其中甲、乙、丙、丁、戊分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种.两圆连线表示二者可以发生反应.已知甲和乙可以通过反应相互转化.请回答下列问题: